 В данной статье мы рассмотрим процесс разработки, подготовки и сопровождения регистрационного досье на медицинское изделие от момента получения стартового технического задания до получения регистрационного удостоверения.
В данной статье мы рассмотрим процесс разработки, подготовки и сопровождения регистрационного досье на медицинское изделие от момента получения стартового технического задания до получения регистрационного удостоверения.
В соответствие с ч.1 ст. 38 Федерального закона от 21.11.2011 №323-ФЗ государственной регистрации подлежат любые инструменты, аппараты, приборы, оборудование, материалы и прочие изделия, применяемые в медицинских целях отдельно или в сочетании между собой, а также вместе с другими принадлежностями, необходимыми для применения указанных изделий по назначению, включая специальное программное обеспечение, и предназначенные производителем (изготовителем) для профилактики, диагностики, лечения и медицинской реабилитации заболеваний, мониторинга состояния организма человека, проведения медицинских исследований, восстановления, замещения, изменения анатомической структуры или физиологических функций организма, предотвращения или прерывания беременности, функциональное назначение которых не реализуется путем фармакологического, иммунологического, генетического или метаболического воздействия на организм человека.
1. Используется ли изделие для:
- диагностики, профилактики или лечения различных заболеваний?
- реабилитации пациента?
- ухода за пациентом?
- мониторинга состояния организма человека?
- проведения медицинских исследований?
- восстановления, замещения, изменения анатомической структуры организма?
2. Применяется ли изделие в медицинских целях отдельно или вместе с принадлежностями?
3. Используется ли изделие для применения в условиях лечебно-профилактических учреждений и медицинских лабораторий?
4. Предназначено ли изделие для обработки, транспортировки или хранения медицинских препаратов и биоматериалов?
5. Предназначено ли для осуществления дезинфекции и/или стерилизации изделий медицинского назначения?
6. Относится ли изделие к номенклатурной классификации медицинских изделий согласно приказу здравоохранения Российской федерации №4н от 06.06.2012?
Если при ответе на один или несколько вопросов можно однозначно ответить «ДА» - значит изделие является медицинским и подлежит государственной регистрации в Росздравнадзоре.
Нередко бывают случаи, когда ответ на вопрос вызывает сомнение и требует более обширного рассмотрения. Для разрешения вопроса является ли изделие медицинским необходимо составить и отправить на адрес Росздравнадзора Письмо – Запрос о предоставлении информации с просьбой дать разъяснение касательно отнесения изделия к медицинскому изделию и необходимости его государственной регистрации.
После того, как Вы удостоверились, что изделие является медицинским можно приступать к сбору документов, входящих в регистрационное досье и его подаче в Росздравнадзор с целью осуществления государственной регистрации. Рассмотрим подробнее каждый этап на структурной схеме, приведенной ниже.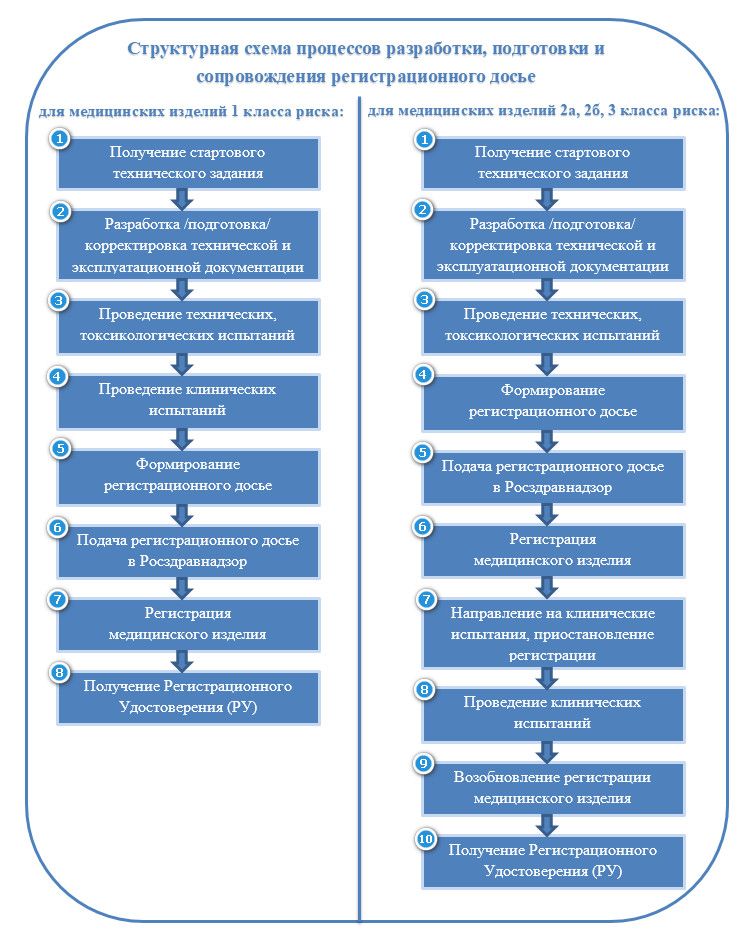
Описание структурной схемы процессов разработки, подготовки и сопровождения регистрационного досье
1. Получение стартового технического задания
Техническое задание представляет собой исходный технический документ для проведения работы, устанавливающий требования к регистрируемому изделию и технической документации на него. В стартовом техническом задании должны быть представлены:
- проект технической документации;
Могут быть предоставлены по применимости и наличию:
· Технические условия ГОСТ 2.114
· Основной или полный комплект конструкторской документации (ГОСТ 2.102)
· Техническое описание
- проект эксплуатационной документации;
Могут быть предоставлены по применимости и наличию:
· Руководство по эксплуатации (в.т.ч. техническому облуживанию и ремонту (ГОСТ 2.602))
· Инструкции по монтажу, пуску, регулированию и обкатке изделия
· Паспорт
· Формуляр
· Этикетка
- информация о применяемых в изделии сырье, материалах, покупных изделиях, особенно контактирующих с пациентом/оператором;
- копии документов, подтверждающие качество условий производства;
Могут быть предоставлены по применимости и наличию:
· Акты и протоколы квалификационных испытаний
· Лицензия на производство медицинской техники
· Сертификаты соответствия ИСО 9001, ИСО 13485
- копии документов, подтверждающих владение изготовителем на законных основаниях производственными площадями (адрес места производства);
Могут быть предоставлены по применимости и наличию:
· Свидетельство(а) о государственной регистрации права
· Договор(а) аренды производственных площадей
· Лицензия на производство медицинской техники
- копии документов, подтверждающих права заявителя (изготовителя) на использование результатов интеллектуальной собственности (товарный знак, знак обслуживания, наименование места происхождение товара, изобретение, полезную модель, промышленный образец);
Могут быть предоставлены по применимости и наличию:
· Свидетельство на товарный знак (знак обслуживания) и свидетельство об исключительном праве на наименование места происхождения товара
· Лицензионный договор или договор коммерческой концессии
· Патент на изобретение, полезную модель или промышленный образец
- фотоматериалы каждого исполнения, модели изделия и принадлежностей достаточного разрешения и качества для формата А4.
2. Разработка/подготовка/корректировка технической и эксплуатационной документации
Первое, с чего начинается этап разработки документации, это составление Заявления о регистрации медицинского изделия. Форма Заявления приведена на сайте Росздравнадзора и заполняется в соответствии с данными по регистрируемому изделию. В данном документе обозначаются организационно-правовые отношения между разработчиком, производителем и уполномоченным производителем, присваивается номер ТУ (только для изделий отечественного производства), указываются варианты исполнения, моделей регистрируемого изделия и определяется принадлежность изделия к:
- виду медицинского изделия в соответствии с номенклатурной классификацией медицинских изделий (согласно приказу министерства здравоохранения Российской Федерации №4н от 06.06.2012);
- классу потенциального риска применения медицинского изделия в соответствии с номенклатурной классификацией медицинских изделий (согласно приказу министерства здравоохранения Российской Федерации №4н от 06.06.2012);
- коду Общероссийского классификатора продукции по видам экономической деятельности (ОКПД 2).
- разработке/корректировке/подготовке технической документации;
После подготовки Заявления о регистрации согласно установленным требованиям, необходимо приступить к:
Для изделий отечественного производства: технические условия (ТУ) медицинского изделия; для изделий иностранного производства: Выписка из технического файла.
- разработке/корректировке/подготовке эксплуатационной документации (инструкция по применению/руководство по эксплуатации);
- разработке отчета по управлению рисками медицинского изделия (Файл менеджмента риска);
- подготовка сведений о нормативной документации медицинского изделия;
- разработке файла проектирования с учетом эксплуатационной пригодности (при необходимости);
- разработке файла жизненного цикла разработки программного обеспечения (при необходимости).
3. Проведение технических, токсикологических испытаний
Для проведения испытаний необходимо предоставить образцы изделий в количестве, необходимом для проведения испытаний.
Технические испытания проводятся с целью определения соответствия характеристик (свойств) медицинского изделия требованиям нормативной, технической и эксплуатационной документации производителя (изготовителя), потому на технические испытания должны быть предоставлены все образцы изделия, имеющие различия по конструктивным особенностям. Подробнее ознакомиться с порядком проведения технических испытаний Вы можете по ссылке в статье «Технические испытания медицинских изделий».
Токсикологические испытания проводятся с целью оценки биологической безопасности медицинского изделия, поэтому на испытания должны предоставляться образцы (допускается предоставление частей (обрезков) изделия размером не менее 10×10 мм) контактирующие с телом человека прямым и опосредованным способом. Подробнее ознакомиться с порядком проведения токсикологических испытаний Вы можете по ссылке в статье «Токсикологические исследования (испытания)».

Внимание! После 3 этапа структурной схемы процессы подготовки и сопровождения регистрационного досье для изделий 1 класса риска и изделий классов риска 2а, 2б и 3 различны, что связано с процедурой государственной регистрации, которая проводится в соответствии с требованиями ППРФ №1416 от 27.12.2012 г. «Об утверждении правил государственной регистрации медицинских изделий».
Дальнейшее описание структурной схемы процессов разработки, подготовки и сопровождения регистрационного досье для изделий 1 класса риска
4. Проведение клинических испытаний
Для изделий 1 класса потенциального риска применения клинические испытания проводятся до подачи регистрационного досье в регистрирующий орган. Клинические испытания проводятся после принятия решения о возможности их проведения по результатам успешного прохождения технических и токсикологических испытаний. Подробнее ознакомиться с порядком проведения технических испытаний Вы ссылке в статье «Клинические испытания».
5. Формирование регистрационного досье
Документы, необходимые для подачи в Росздравнадзор для осуществления процедуры государственной регистрации медицинского изделия, формируются в регистрационное досье. В силу того, что подготовка регистрационного досье имеет определенный ряд особенностей для изделий отечественного и иностранного производства, информация по его формированию рассмотрена в отдельной статье «Регистрационное досье».
 Внимание! Важно помнить, что:
Внимание! Важно помнить, что: - Заявлению о регистрации медицинского изделия перед отправкой должны быть присвоены исходящий номер и дата. Данные сведения необходимы для начала отслеживания регистрационного досье (дела) в регистрирующем органе.
- Все документы регистрационного досье должны быть заверены в установленном порядке.
- Каждый документ описи регистрационного досье, содержащий две и более страниц, должен быть прошит.
- На сшивке должно быть указано количество страниц, подпись уполномоченного лица (директора, генерального директора), дата заверения документа и печать.
6. Подача регистрационного досье в Росздравнадзор
Регистрационное досье, содержащее документы, заверенные в установленном порядке, подготовленные в соответствии с ППРФ №1416 от 27.12.2012 г. «Об утверждении правил государственной регистрации медицинских изделий», должны быть направлены на адрес Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор).
7. Регистрация мед. изделия
Процедура государственной регистрации медицинского изделия проводится в соответствии с постановлением Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении Правил государственной регистрации медицинских изделий». Подробно с поэтапным отслеживанием процедуры государственной регистрации медицинского изделия на всех этапах проверки в Росздравнадзоре Вы можете в статье «Рассмотрение регистрационного досье в Росздравнадзоре».
8. Получение РУ
По факту успешного прохождения регистрации медицинского изделия в регистрируемом органе будет выдано РУ. Об этом будет свидетельствовать запись в графе «Результат» Кабинета Заявителя на официальном сайте https://roszdravnadzor.gov.ru, где появится статус «Выдано Регистрационное удостоверение №РЗН ХХХ/ХХХХХ от ДД.ММ.ГГ. Приказ от ДД.ММ.ГГ №ХХХХ». А также данные по зарегистрированному изделию отобразятся на сайте https://roszdravnadzor.gov.ru в разделе: Государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий».
Для проверки отображения зарегистрированного изделия в государственном реестре введите наименование медицинского изделия в поле «1», как показано на рисунке ниже, после чего нажмите в области поля «2» для поиска. Подождите, пока в поле «3» отобразится результат поиска.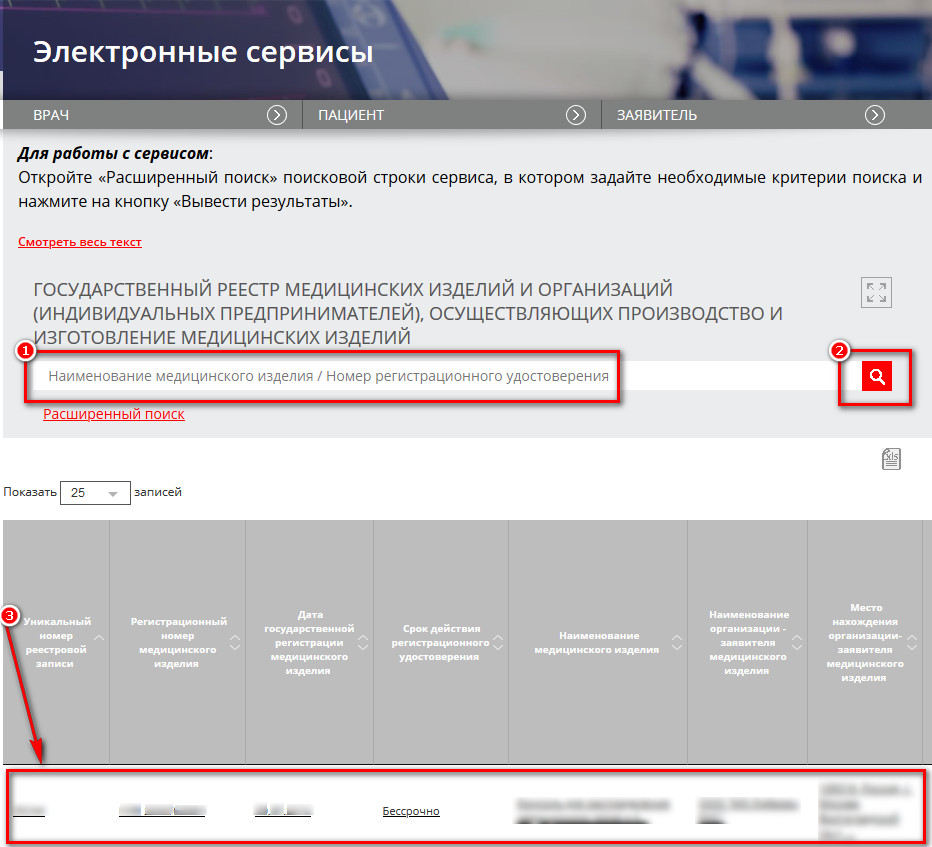
Дальнейшее описание структурной схемы процессов разработки, подготовки и сопровождения регистрационного досье для изделий классов риска 2а, 2б и 3
4. Формирование регистрационного досье
После того, как будут получены положительные заключения по результатам проведения технических и токсикологических испытаний необходимо приступить к формированию регистрационного досье на подачу. В силу того, что подготовка регистрационного досье имеет определенный ряд особенностей для изделий отечественного и иностранного производства, информация по его формированию рассмотрена в отдельной статье «Регистрационное досье».

- Важно помнить, что:
- Заявлению о регистрации медицинского изделия перед отправкой должны быть присвоены исходящий номер и дата. Данные сведения необходимы для начала отслеживания регистрационного досье (дела) в регистрирующем органе.
- Все документы регистрационного досье должны быть заверены в установленном порядке.
- Каждый документ описи регистрационного досье, содержащий две и более страниц, должен быть прошит.
- На сшивке должно быть указано количество страниц, подпись уполномоченного лица (директора, генерального директора), дата заверения документа и печать.
5. Подача регистрационного досье в Росздравнадзор
Регистрационное досье, содержащее документы, заверенные в установленном порядке, подготовленные в соответствии с ППРФ №1416 от 27.12.2012 г. «Об утверждении правил государственной регистрации медицинских изделий», должны быть направлены на адрес Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор).
6. Регистрация медицинского изделия
Процедура государственной регистрации медицинского изделия проводится в соответствии с постановлением Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении Правил государственной регистрации медицинских изделий». Подробно с поэтапным отслеживанием процедуры государственной регистрации медицинского изделия на всех этапах проверки в Росздравнадзоре Вы можете в статье «Рассмотрение регистрационного досье в Росздравнадзоре».
7. Направление на клинические испытания, приостановление регистрации
Медицинским изделиям классов риска 2а, 2б и 3 после успешного прохождения I этапа экспертизы качества, эффективности и безопасности выдается разрешение на клинические испытания с бессрочным приостановлением процедуры регистрации.
8. Проведение клинических испытаний
Клинические испытания проводятся после принятия решения о возможности их проведения по результатам успешного прохождения технических и токсикологических испытаний. Подробнее ознакомиться с порядком проведения технических испытаний Вы ссылке в статье «Клинические испытания».
9. Возобновление регистрации медицинского изделия
После прохождения клинических испытаний результаты их прохождения медицинским изделием направляются в регистрирующий орган с указанием необходимости приложить документы к регистрационному досье под соответствующим входящим номером. По факту получения документов, подтверждающих проведение клинических испытаний, процесс регистрации медицинского изделия возобновится и регистрационное досье направится на II этап экспертизы качества, эффективности и безопасности.
10. Получение (РУ)
По факту успешного прохождения регистрации медицинского изделия в регистрируемом органе будет выдано РУ. Об этом будет свидетельствовать запись в графе «Результат» Кабинета Заявителя на официальном сайте https://roszdravnadzor.gov.ru, где появится статус «Выдано Регистрационное удостоверение №РЗН ХХХ/ХХХХХ от ДД.ММ.ГГ. Приказ от ДД.ММ.ГГ №ХХХХ». А также данные по зарегистрированному изделию отобразятся на сайте https://roszdravnadzor.gov.ru в разделе: Государственный реестр медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий».
Для проверки отображения зарегистрированного изделия в государственном реестре введите наименование медицинского изделия в поле «1», как показано на рисунке ниже, после чего нажмите в области поля «2» для поиска. Подождите, пока в поле «3» отобразится результат поиска.
Заключение
После принятия решения о выдаче РУ Изготовителю (уполномоченному представителю) необходимо обратиться в регистрирующий орган для получения оригинала РУ. Получить оригинал может любое доверенное лицо, имеющее соответствующую доверенность на забор документа с указанием присвоенного номера и даты выдачи в соответствии с реестровой записью Росздравнадзора. Также РУ на зарегистрированное изделие можно скачать в свободном доступе из раздела «Реестровая запись», как показано на рисунке ниже.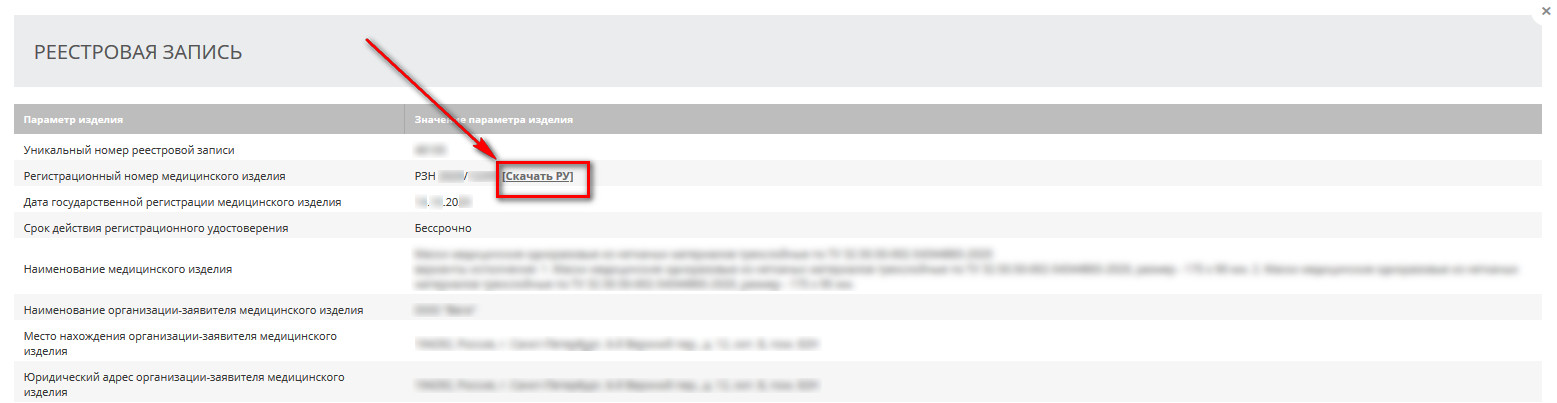
Таким образом, мы рассмотрели этапы получения Регистрационного Удостоверения состоящие из процессов разработки, подготовки и сопровождения регистрационного досье на медицинское изделие. Сертификационный центр ООО «Невасерт» оказывает весь спектр услуг, заключающийся в подготовке документов регистрационного досье; занимается организацией и проведением технических, токсикологических и клинических испытаний; а также сопровождением, консультированием на всех этапах подготовки документов и регистрации медицинского изделия.
Услуги: Регистрация медицинских изделий, Регистрация медицинских изделий в Казахстане, Регистрация по ЕАЭС, Регистрация медицинских изделий in vitro, Регистрация медицинских изделий по ППРФ 552 (ускоренная процедура), Сертификация медицинских изделий.





