 Регистрация медицинских изделий – это государственная процедура, цель которой разрешить выпуск на российский рынок качественных и безопасных изделий. В данной статье будет рассмотрен процесс отслеживания на всех этапах рассмотрения регистрационного досье от момента подачи eгo в Федеральную службу по надзору в сфере здравоохранения (Росздравнадзор) до уведомления о выдаче регистрационного удостоверения.
Регистрация медицинских изделий – это государственная процедура, цель которой разрешить выпуск на российский рынок качественных и безопасных изделий. В данной статье будет рассмотрен процесс отслеживания на всех этапах рассмотрения регистрационного досье от момента подачи eгo в Федеральную службу по надзору в сфере здравоохранения (Росздравнадзор) до уведомления о выдаче регистрационного удостоверения.
Процедура государственной регистрации медицинского изделия проводится в соответствии с постановлением Правительства Российской Федерации от 27.12.2012 № 1416 «Об утверждении Правил государственной регистрации медицинских изделий».

Внимание! Заявлению о регистрации медицинского изделия перед отправкой должны быть присвоены исходящий номер и дата. Данные сведения необходимы для начала отслеживания регистрационного досье (дела) в регистрирующем органе.
После отправки регистрационного досье на адрес Росздравнадзора, ответственный за отслеживанием информации о ходе процедуры государственной регистрации должен пользоваться ресурсами сайта https://roszdravnadzor.gov.ru.
1) Получение входящего номера Заявления о регистрации Росздравнадзора
1.1) На сайте https://roszdravnadzor.gov.ru необходимо выбрать поле «Информация о ходе рассмотрения документов», находящуюся во вкладке «Электронные ресурсы».

1.2) Далее откроется окно, в котором необходимо выбрать поле «Информация о ходе рассмотрения обращений от юридических/физических лиц».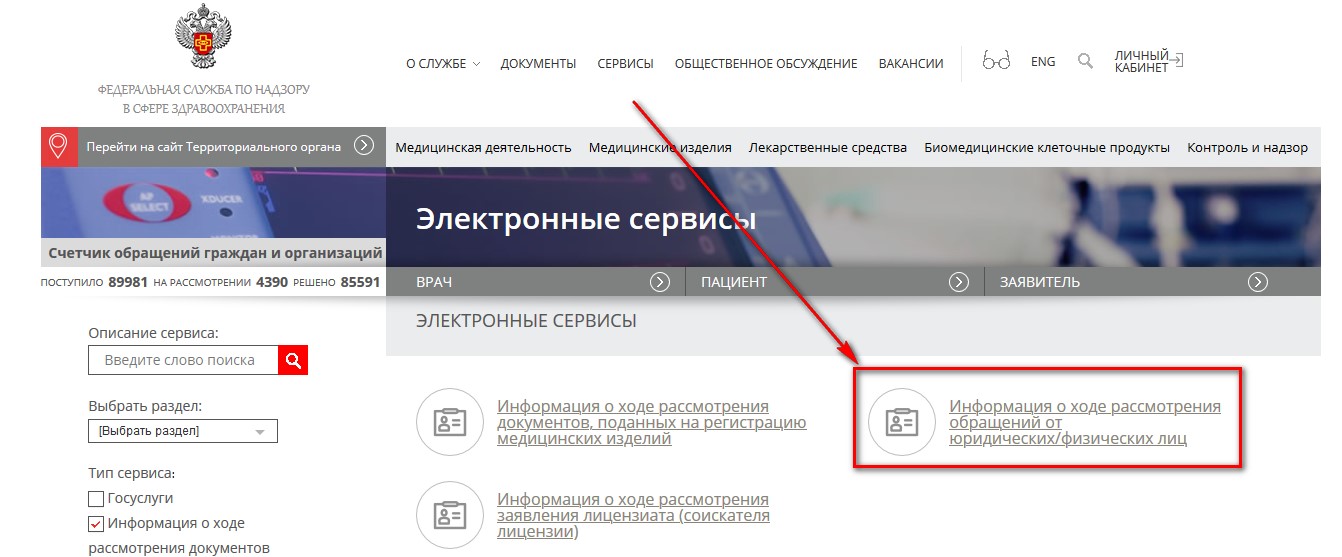
1.3) В открывшемся окне необходимо ввести параметры поиска. Нажмите на выпадающий список и выберите первый параметр «по номеру и дате Вашего исходящего», в графе «Номер» и «Дата» укажите соответственно номер и дату, присвоенные Заявлению на этапе отправки документов.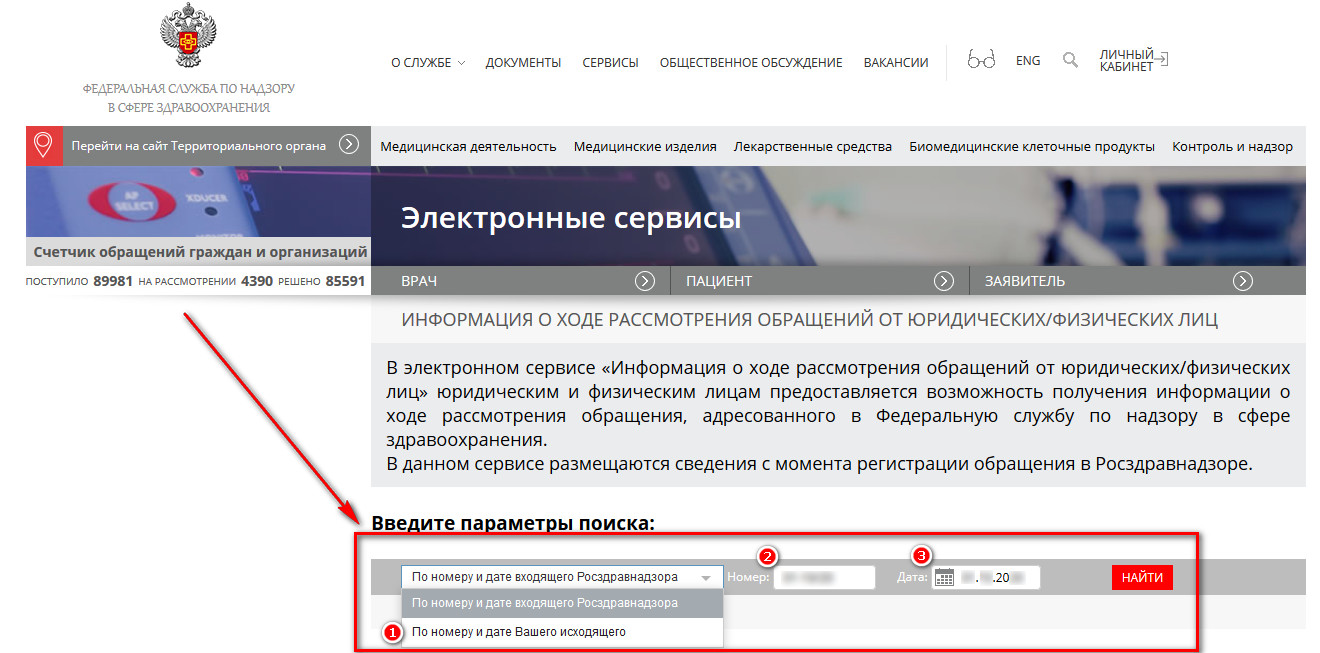
1.4) Если появится сообщение «По Вашему запросу ничего не найдено» - это будет означать, что документы на момент запроса информации не поступили в регистрирующий орган или не прошли обработку.
1.5) В случае, если в открывшемся окне появились результаты поиска, необходимо с ними ознакомиться, зафиксировать входящий номер и дату. После того, как в графе «Ход рассмотрения» статус поменяется на «Рассмотрено», можно переходить к следующему этапу отслеживания.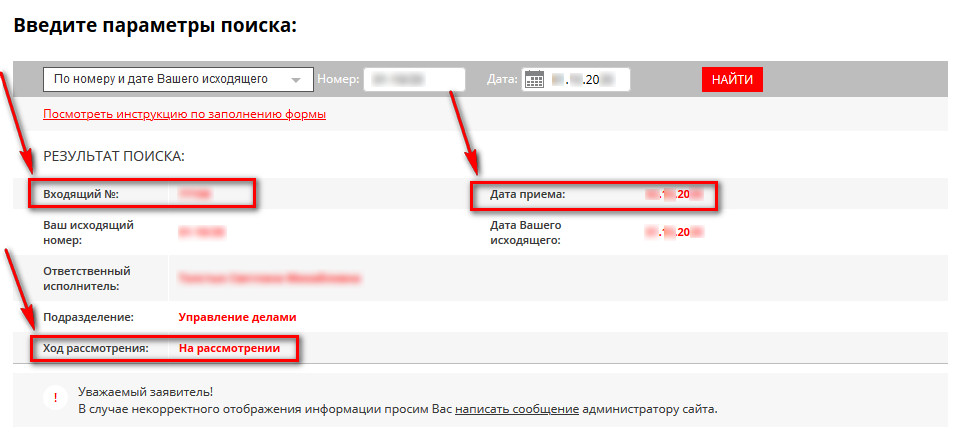
2) Отслеживание информации о ходе рассмотрения документов, поданных на регистрацию медицинского изделия
2.1) Повторяем действие пункта 1.1, затем в открывшемся окне выбираем «Информация о ходе рассмотрения документов, поданных на регистрацию медицинских изделий».
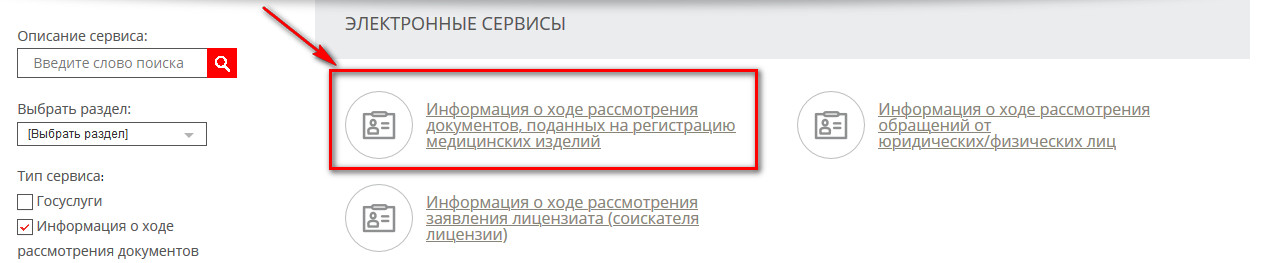
2.2) Попадаем на страницу кабинета заявителя где необходимо ввести параметры поиска. Нажмите на выпадающий список и выберите первый параметр «Входящий номер заявления о регистрации». Во втором выпадающем списке должен остаться по умолчанию прочерк «-». В графе третьего параметра введите Входящий номер, присвоенный регистрационному досье на предыдущем этапе и соответственно в графе четвертого параметра дату приема.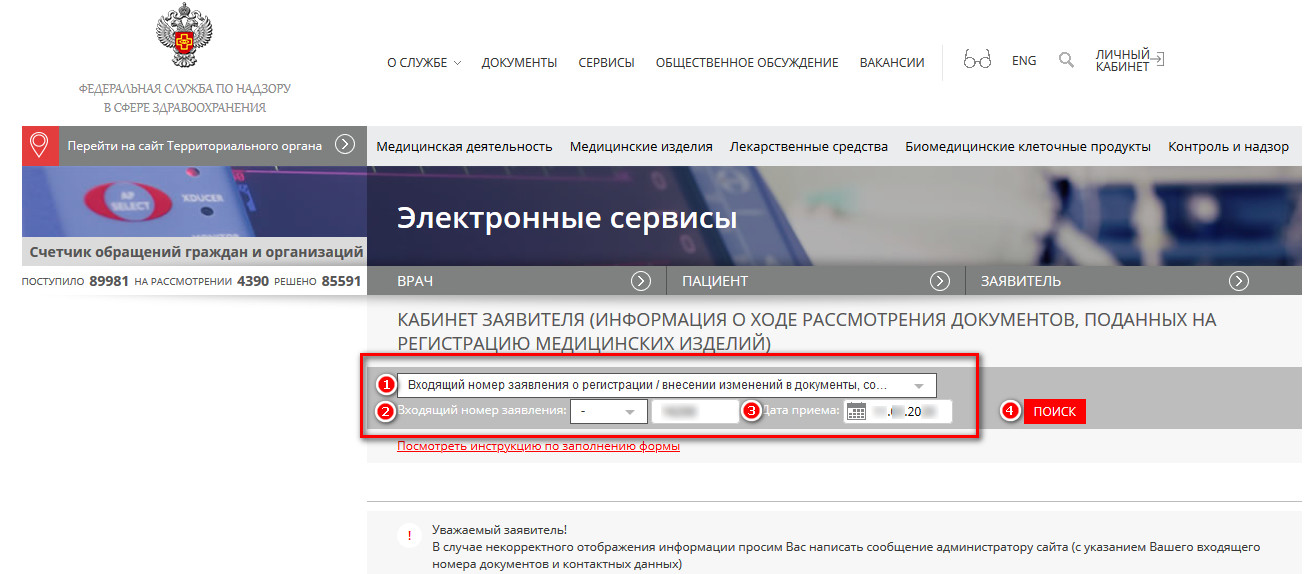
2.3) Если высветится сообщение «Дело о регистрации медицинского изделия с таким входящим номером и датой отправки не найдено. Проверьте правильность вводимых данных» - это означает, что дело находится на рассмотрении и кабинет заявителя еще не сформирован.
2.4) Если в открывшемся окне появились результаты поиска, то это означает, что процедура государственной регистрации медицинского изделия запущена и регистрационное досье начинает проходить этапы проверки.

Внимание! С момента появления данных в окне «Кабинет заявителя», ответственный за отслеживанием, будет получать сведения и уведомления постепенно по факту прохождения соответствующих этапов государственной регистрации. Окно «Кабинет заявителя» становится не только главным источником получения информации о ходе процедуры государственной регистрации медицинского изделия, но и средством взаимодействия с регистрирующим органом.

Внимание! «Кабинет заявителя» состоит из граф, количество которых может варьироваться в зависимости от результатов прохождения проверки на этапах государственной регистрации. В том числе, количество граф различно для изделий 1 класса риска и классов риска 2а, 2б и 3, что связано с процедурой государственной регистрации, которая проводится в соответствии с требованиями ППРФ №1416 от 27.12.2012 г. «Об утверждении правил государственной регистрации медицинских изделий».
На начальном этапе назначается ответственный проверяющий эксперт с указанием Ф.И.О., номера телефона для связи, а также рабочей почты в графе «2. Назначение ответственного исполнителя».
Далее в графе «3. Проверка полноты и достоверности» должен появиться соответствующий результатам проверки на наличие нарушений в оформлении, полноте и корректности документации статус.
- «Нарушений нет» - то это означает, что данный этап пройден без выявленных нарушений.
- «Направлено уведомление № ХХ-ХХХХ/ХХ от ДД.ММ.ГГ о необходимости устранения выявленных нарушений и (или) представления отсутствующих документов» - это означает о выявленных нарушениях, которые необходимо устранить в 30-дневный срок от даты направления заявителю уведомления. Для получения и ознакомления с уведомлением необходимо нажать на красный конверт. Уведомление будет выслано на почтовый адрес, который был указан в Заявлении о регистрации.
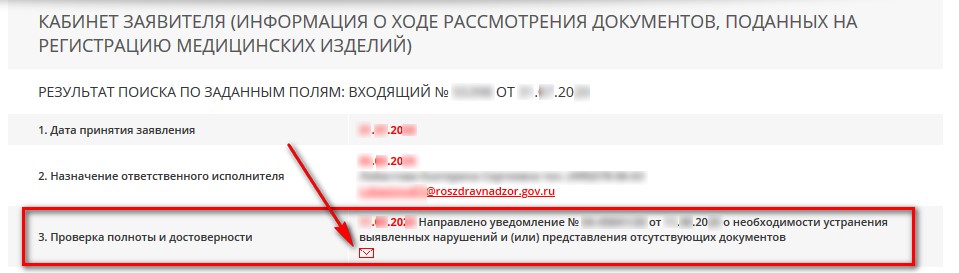

Внимание! Если уведомление не поступило на указанную почту, необходимо повторно нажать на конверт. В случае, если уведомление так и не поступило заявителю, необходимо связаться с ответственным исполнителем и уточнить правильность и корректность записи почтового адреса получателя.
После того, как Заявитель устранил все замечания из уведомления Росздравнадзора, он должен составить акт устранения нарушений и направить eгo совместно со скорректированными, дополнительными материалами на адрес Росздравнадзора не позднее назначенного срока.

Внимание! После графы «3. Проверка полноты и достоверности» номера граф указываются последовательно в соответствии с формированием запросов и прохождения этапов проверки.
В графе «Ожидание дополнительных материалов» появится статус «Получены дополнительные материалы» и будет указана дата приема документов.
В графе «Устранение нарушений» должен появиться статус:
- «Нарушения не устранены. Направлено уведомление № ХХ-ХХХХ/ХХ от ДД.ММ.ГГ о прекращении процедуры регистрации» - в данном случае произойдет возврат Заявителю Заявления о регистрации медицинского изделия и регистрационного досье, процедура государственной регистрации будет прекращена.
- «Нарушения устранены» - в данном случае, регистрирующий орган направляет регистрационное досье на следующий этап проверки.
В графе «Принятие решения о начале регистрации» отобразится дата.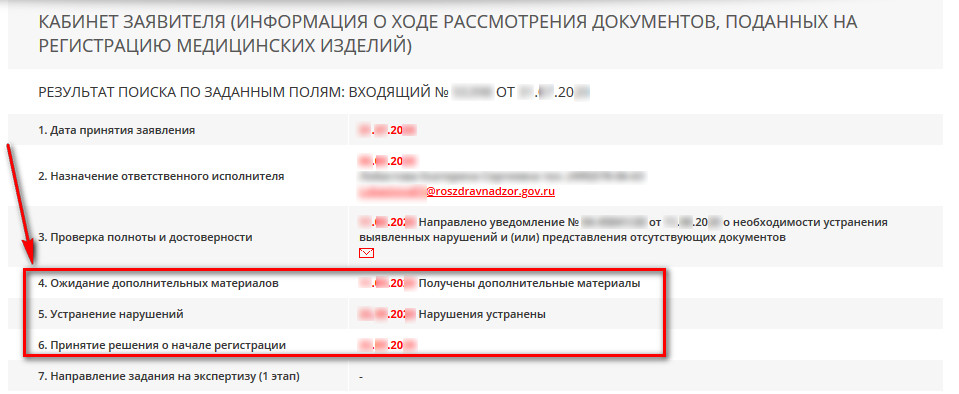
«Кабинет заявителя» изделий 1 класса риска
Если изделие 1 класса риска или изделие in vitro, то в графах «Направление задания на экспертизу (I этап)», «Направление на клинические испытания. Приостановление регистрации», «Возобновление регистрации» будут указаны прочерки и регистрационное досье сразу переходит ко II этапу. В графе «Направление задания на экспертизу (II этап)» появится статус: «Направлено в экспертное учреждение на экспертизу». Связано это с тем, что клинические испытания для изделий 1 класса риска и изделий in vitro проводятся до подачи документов в Росздравнадзор и входят в состав регистрационного досье.
- Если по факту проведения экспертизы нарушений нет, то в графе «Заключение по этапам экспертизы (II этап) появится статус: «Качество и/или эффективность и/или безопасность регистрируемого медицинского изделия подтверждены» и в графе «Результат» появится статус «Выдано Регистрационное удостоверение №РЗН ХХХ/ХХХХХ от ДД.ММ.ГГ. Приказ от ДД.ММ.ГГ №ХХХХ».

- В случае выявленных нарушений на II этапе проверки будет направлено уведомление: «Направлен запрос о предоставлении дополнительных материалов и сведений № ХХ-ХХХХ/ХХ от ДД.ММ.ГГ», которые необходимо устранить в срок, не превышающий 50 рабочих дней от даты направления заявителю уведомления. Нажмите на красный конверт. По факту корректировки документации необходимо направить дополнительные сведения совместно с актом устранения. После получения документов Роздравнадзором документы будут перенаправлены в экспертное учреждение. При положительном решении будет выдано регистрационное удостоверение, об этом будет свидетельствовать запись в графе «Результат», как в примере выше.
«Кабинет заявителя» для изделий классов риска 2а, 2б, 3
Если изделие классов риска 2а, 2б, 3, то регистрационное досье переходит на I этап, где осуществляется экспертиза заявления о регистрации и документов, для определения возможности (невозможности) проведения клинических испытаний медицинского изделия.
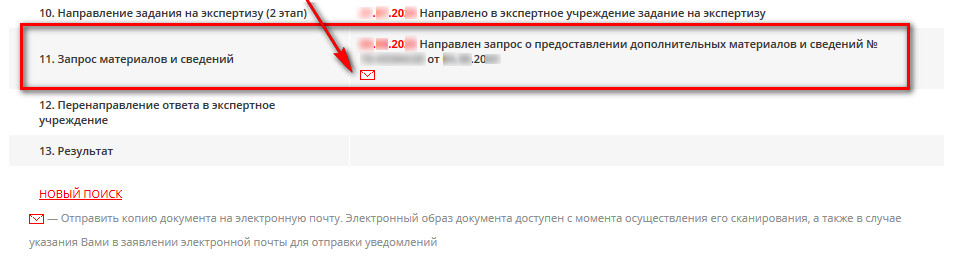
В графе «Направление задания на экспертизу (I этап)» появится статус «Направлено в экспертное учреждение задание на экспертизу» с указанием даты. В случае, если появятся замечания по факту прохождения I этапа экспертизы качества, эффективности и безопасности регистрируемого медицинского изделия, появится графа «Запрос материалов и сведений» где будет указан статус уведомления: «Направлено уведомление №ХХ-ХХХХ/ХХ от ДД.ММ.ГГ о необходимости устранения выявленных нарушений и (или) представления отсутствующих документов» - это означает о выявленных замечаниях к документации Заявителя, которые необходимо устранить в срок не превышающий 50 рабочих дней от даты направления заявителю уведомления. Для получения и ознакомления с уведомлением необходимо нажать на красный конверт. Уведомление будет выслано на почтовый адрес, который был указан в Заявлении о регистрации.
После того, как Заявитель устранил все замечания из уведомления Росздравнадзора, он должен составить акт устранения нарушений и направить eгo совместно со скорректированными, дополнительными материалами на адрес Росздравнадзора не позднее назначенного срока. В графе «Ожидание дополнительных материалов» появится статус «Получены дополнительные материалы» и будет указана дата приема документов. По факту рассмотрения полученных документов в графе «Перенаправление ответа в экспертное учреждение» должен появиться статус: «Дополнительные сведения от заявителя перенаправлены в экспертное учреждение» с указанием даты отправки. В случае положительного заключения в графе «Заключение о возможности направления на клинические испытания» появится статус «Положительное заключение».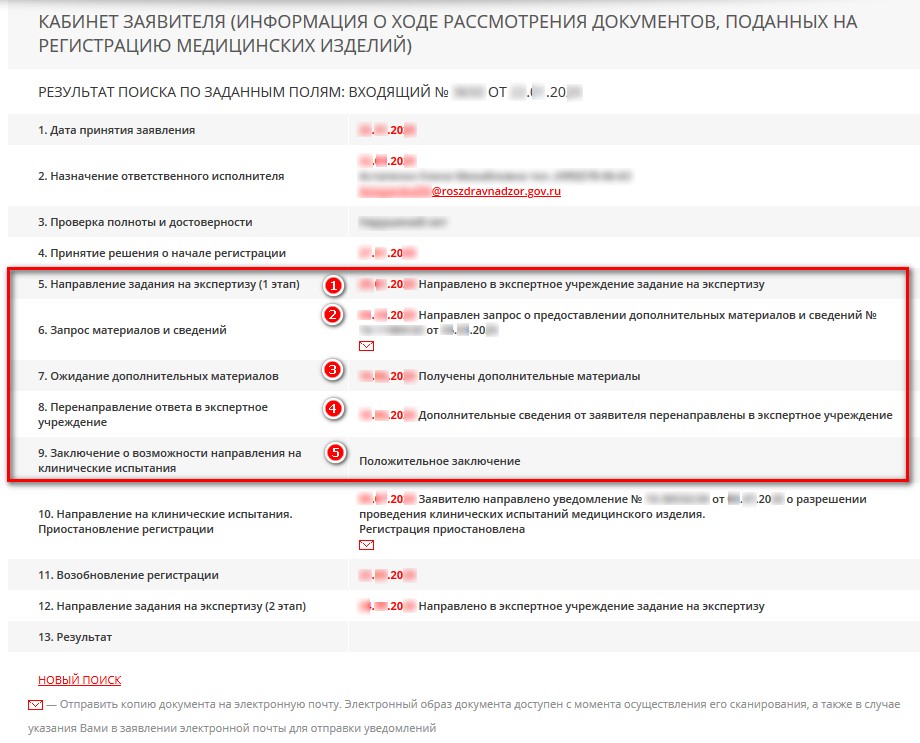
Это будет означать, что все нарушения устранены, предоставлены необходимые корректировки и уточнения запрашиваемой информации, подтверждающие качество эффективность и безопасность регистрируемого изделия. В графе «Направление на клинические испытания. Приостановление регистрации» появится уведомление «Заявителю направлено уведомление «ХХ-ХХХХ/ХХ от ДД.ММ.ГГ о разрешении проведения клинических испытаний медицинского изделия. Регистрация приостановлена».
С того момента, как регистрация остановлена сроки не устанавливаются и предоставление клинических испытаний происходит по факту их завершения. Заявителем направляется Заключение клинических испытаний в ответ на уведомление. После чего регистрация будет возобновлена и регистрационное досье совместно с Заключение клинических испытаний отправляется на II этап экспертизы, где будет осуществляться экспертиза полноты и результатов проведенных технических испытаний, токсикологических исследований, клинических испытаний, а также испытаний в целях утверждения типа средств измерений.
При прохождении II этапа и положительном решении будет выдано регистрационное удостоверение, об этом будет свидетельствовать запись в графе «Результат», где появится статус «Выдано Регистрационное удостоверение №РЗН ХХХ/ХХХХХ от ДД.ММ.ГГ. Приказ от ДД.ММ.ГГ №ХХХХ».
Заключение
В данной статье было рассмотрено поэтапное отслеживание процедуры государственной регистрации медицинского изделия на всех этапах проверки в Росздравнадзоре на базе ресурсов официального сайта https://roszdravnadzor.gov.ru, что является единственным источником взаимодействия заявителя с регистрирующим органом. Статья подготовлена сертификационном центром ООО «Невасерт».





