 Регистрационное досье - комплект документов, представляемых для государственной регистрации медицинского изделия, или внесения изменений в уже зарегистрированное изделие, в соответствии с постановлением правительства Российской Федерации № 1416 от 27 декабря 2012 г. «Об утверждении Правил государственной регистрации медицинских изделий».
Регистрационное досье - комплект документов, представляемых для государственной регистрации медицинского изделия, или внесения изменений в уже зарегистрированное изделие, в соответствии с постановлением правительства Российской Федерации № 1416 от 27 декабря 2012 г. «Об утверждении Правил государственной регистрации медицинских изделий».
Согласно постановления ППРФ №1416 от 27 декабря 2012 г. перечень необходимых документов, подаваемых в Росздравнадзор для оформления государственной регистрации медицинского изделия и получения регистрационного удостоверения должен включать в себя следующие документы:
- заявление о регистрации;
- опись документов;
- копию документа, подтверждающего полномочия уполномоченного представителя производителя (изготовителя);
- сведения о нормативной документации на медицинское изделие;
- техническая документация производителя (изготовителя) на медицинское изделие;
- эксплуатационная документация производителя (изготовителя) на медицинское изделие;
- фотографические изображения общего вида медицинского изделия;
- документы, подтверждающие результаты технических испытаний медицинского изделия;
- документы, подтверждающие результаты токсикологических исследований медицинского изделия;
- документы, подтверждающие результаты испытаний медицинского изделия в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений, перечень которых утверждается Министерством здравоохранения Российской Федерации);
- сведения, подтверждающие клиническую эффективность и безопасность медицинских изделий (для медицинских изделий 1 класса потенциального риска применения и медицинских изделий для диагностики in vitro).
Регистрируемое медицинское изделие может быть разработано и/или произведено как отечественным, так и иностранным производителем. В соответствии с этим перечень документов, представляемых в регистрационном досье, может значительно отличаться. Рассмотрим этот вопрос более детально в таблице ниже. В графе «Изделия отечественного производства» и «Изделия иностранного производства» знаками плюс и минус отмечена необходимость предоставления документа (представленного в графе «Документ») в Регистрационном досье. Также важно помнить, что каждое медицинское изделие имеет назначение и область применения, что говорит о необходимости предоставления в регистрационном досье документов, обозначенных в таблице «при необходимости».
| № п/п | Документ | Изделия отечественного производства | Изделия иностранного производства |
|---|---|---|---|
| 1. | Заявление в РЗН | + | + |
| 2. | Опись документов | + | + |
| 3. | Копия документа, подтверждающего полномочия уполномоченного представителя производителя (изготовителя) | - * отечественный производитель не нуждается в уполномоченном представителе | + |
| 4. | Сведения о нормативной документации на медицинское изделие | + | + |
| 5. | Техническая документация производителя (изготовителя) на медицинское изделие | (в соответствии с | Выписка из технической документации (технического файла) Изготовителя с учетом требований Приказа № 11н |
| 6. | Эксплуатационная документация производителя (изготовителя) на медицинское изделие | Инструкция / руководство по эксплуатации (в соответствии с с учетом требований Приказа № 11н | Инструкция / руководство по эксплуатации Изготовителя с учетом требований Приказа № 11н |
| 7. | Фотографические изображения общего вида медицинского изделия | + | + |
| 8. | + | - | |
| 9. | Документы, подтверждающие результаты технических испытаний медицинского изделия | Акт оценки результатов технических испытаний медицинского изделия, Программа, Протокол | Акт оценки результатов технических испытаний медицинского изделия, Программа, Протокол |
| 10. | Протокол испытаний на соответствие параметрам электромагнитной совместимости | + (при необходимости) | + (при необходимости) |
| 11. | Документы, подтверждающие результаты токсикологических исследований медицинского изделия | Заключение по результатам токсикологических исследований медицинского изделия, Программа, Протокол | Заключение по результатам токсикологических исследований медицинского изделия, Программа, Протокол *Как правило, не требуется для изделий in vitro диагностики |
| 12. | Документы, подтверждающие результаты испытаний медицинского изделия в целях утверждения типа средств измерений (в отношении медицинских изделий, относящихся к средствам измерений в сфере государственного регулирования обеспечения единства измерений) | + (при необходимости) | + (при необходимости) |
| 13. | Сведения, подтверждающие клиническую эффективность и безопасность медицинских изделий | Акт оценки результатов клинических испытаний, Программа, Протокол | Акт оценки результатов клинических испытаний, Программа, Протокол |
| 14. | Договор на выполнение работ по производству продукции (в случаях контрактного производства) | Договор контрактного производства | Договор контрактного производства (OEM) |
| 15. | Договор аренды производственного помещения или свидетельство на право собственности | + | - |
| 16. | Документы, подтверждающие регистрацию организации-изготовителя в качестве юридического лица | + | + *Бизнес лицензия, Свидетельство об учреждении и т.д., выданные государственным органом, осуществляющим регистрацию предприятий, компаний и фирм |
| 17. | Документы, подтверждающие соответствие изделия медицинского назначения его требованиям | - | + *Декларация соответствия в соответствии с Директивой по медицинским приборам 93/42/ЕЕС и Директивой Европейского парламента и Совета Европейского Союза |
| 18. | Документы, подтверждающие качество условий производства | ± *Сертификат системы менеджмента качества в соответствии с ГОСТ ISO 13485-2017, Сертификат ГОСТ Р ИСО 9001-2015 или Лицензия на производство медицинской техники | + *Сертификат системы менеджмента качества в соответствии с |
| 19. | Сертификат соответствия ЕС в соответствии с Приложением II Директивы по медицинским приборам 93/42/ЕЕС | - | + |
| 20. | Документы, подтверждающие права Изготовителя на использование результатов интеллектуальной собственности (товарный знак, знак обслуживания и т.д.) | + *Свидетельство на товарный знак (знак обслуживания), Лицензионный договор, Патент на изобретение | + *Документ, свидетельствующий о регистрации товарного знака на территории РФ |
| 21. | Файл менеджмента риска на медицинское изделие с учетом стандарта «Изделия медицинские. Применение менеджмента риска к медицинским изделиям» | + (при необходимости в соответствии с | + (при необходимости в соответствии с |
| 22. | Файл проектирования с учетом эксплуатационной пригодности с учетом стандарта «Изделия медицинские. Проектирование медицинских изделий с учетом эксплуатационной пригодности» | + (при необходимости в соответствии с | + (при необходимости в соответствии с |
| 23. | Файл жизненного цикла разработки программного обеспечения с учетом стандарта «Изделия медицинские. Программное обеспечение. Процессы жизненного цикла» | + (при необходимости в соответствии с | + (при необходимости в соответствии с |
| 24. | Разрешение на ввоз медицинского изделия | - *требуется в случае нахождения производственной площадки вне территории РФ) | + |
| 25. | Документ, свидетельствующий об уплате государственных пошлин | + | + |
В таблице перечислены документы, которые подаются в Росздравнадзор для осуществления процедуры регистрации медицинского изделия. Как видно из таблицы, регистрационного досье для отечественного и иностранного производства в основном имеют различия, заключающиеся в установлении договорных отношений и подтверждения прав на производство медицинских изделий. Для примера рассмотрим форму описи документов на изделие отечественного производства на рисунке 1 и иностранного производства на рисунке 2.
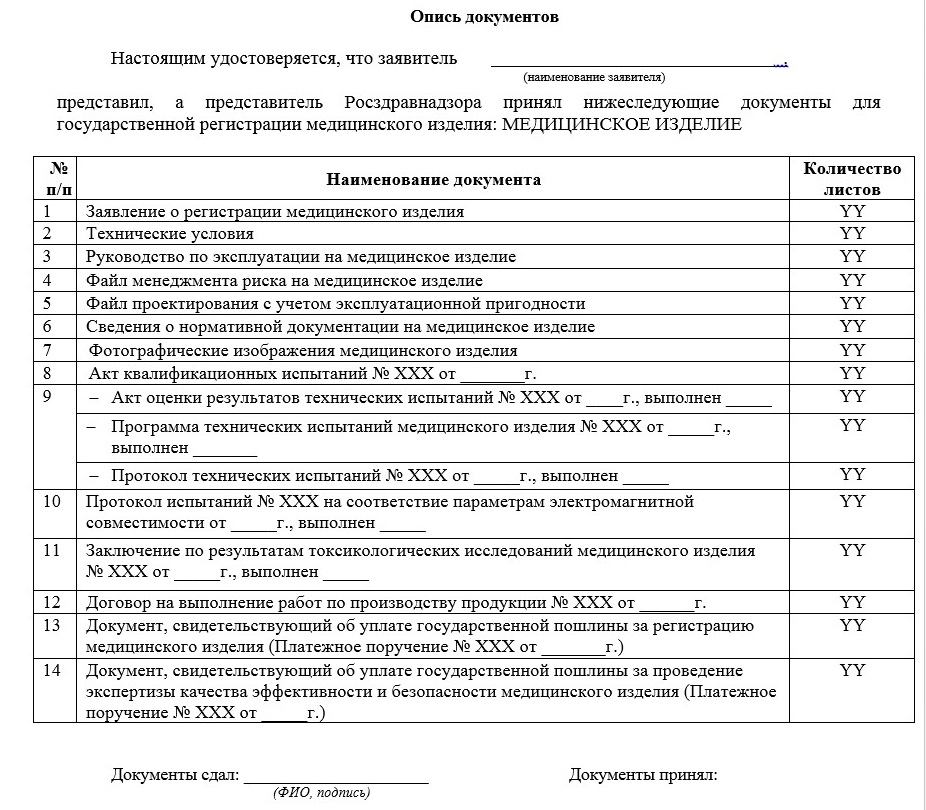
Рисунок 1 – Пример описи документов на медицинское изделие отечественного производства
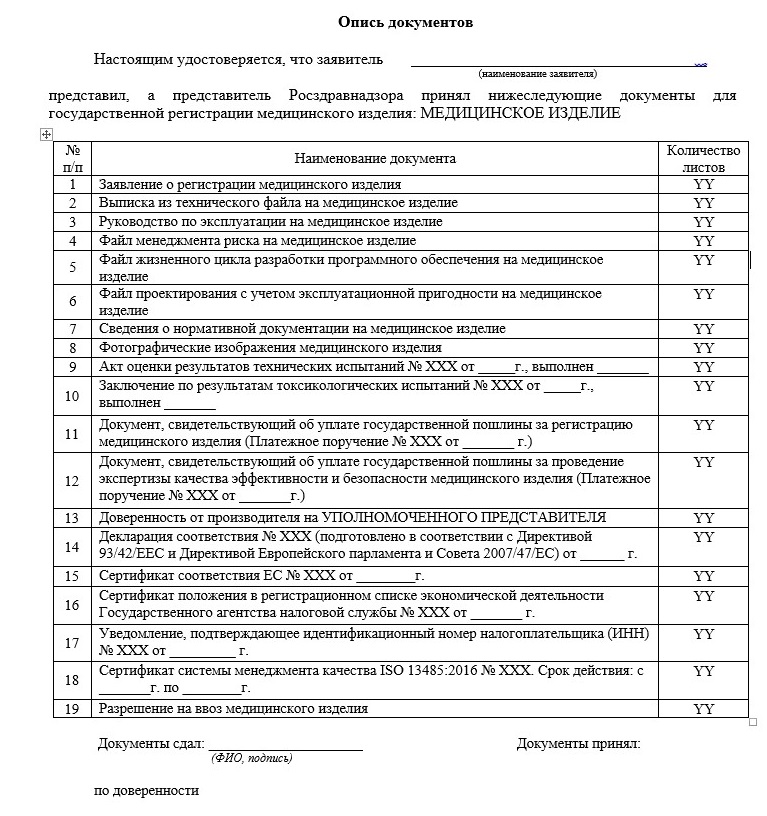
Рисунок 2 – Пример описи документов на медицинское изделие иностранного производства
Информация, представленная в статье, основана на необходимых требованиях, предъявляемых ППРФ №1416 от 27 декабря 2012 г. к Регистрационному досье, и многолетнему опыту регистрации медицинских изделий Сертификационным центром «Невасерт».





