 Нередко бывают случаи, когда подаваемый комплект регистрационного досье на медицинское изделие с целью осуществления его государственной регистрации, направляется сотрудниками Роздравнадзора в отказные. Уведомление об отказе в регистрации медицинского изделия может быть направлено заявителю на любом этапе рассмотрения документов. Отказ может быть связан с несвоевременной подачей запрашиваемых документов, предоставлением некорректных документов, с не устранением выявленных нарушений и т.д. В настоящей статье мы подробно рассмотрим каждый случай, по которому может быть выдано уведомление об отказе в государственной регистрации медицинского изделия и варианты повторной подачи регистрационного досье на регистрацию.
Нередко бывают случаи, когда подаваемый комплект регистрационного досье на медицинское изделие с целью осуществления его государственной регистрации, направляется сотрудниками Роздравнадзора в отказные. Уведомление об отказе в регистрации медицинского изделия может быть направлено заявителю на любом этапе рассмотрения документов. Отказ может быть связан с несвоевременной подачей запрашиваемых документов, предоставлением некорректных документов, с не устранением выявленных нарушений и т.д. В настоящей статье мы подробно рассмотрим каждый случай, по которому может быть выдано уведомление об отказе в государственной регистрации медицинского изделия и варианты повторной подачи регистрационного досье на регистрацию.

Итак, как уже было установлено в статье «Рассмотрение регистрационного досье» процесс рассмотрения документов, поданных на регистрацию медицинских изделий:
- классов риска 2а, 2б, 3 состоит из трех этапов: нулевой (начальный), I и II.
- 1 класса риска проходит в два этапа: нулевой (начальный) и II.
Нулевой этап рассмотрения документов
Нулевой этап является проверкой полноты и достоверности поданного регистрационного досье: проверка на наличие нарушений в оформлении, полноте и корректности представленной документации. Если нарушений не выявлено регистрационное досье переходит на следующий этап. Если на нулевом этапе направляется «Уведомление о необходимости устранения выявленных нарушений и (или) представления отсутствующих документов», то заявитель должен устранить все замечания из уведомления в 30-дневный срок.
Критерии для отказа в регистрации медицинского изделия на нулевом этапе:
1) изделие не является медицинским;
2) заявитель предоставил не все документы, запрашиваемые экспертным учреждением;
3) заявитель не предоставил документы в 30-дневный срок.
Необходимо соблюдать сроки устранения замечаний, регламентированных требованиями ППРФ №1416 от 27.12.2012 г. «Об утверждении правил государственной регистрации медицинских изделий».
В качестве оповещения об отказе на нулевом этапе направляется «Уведомление о возврате заявления о государственной регистрации медицинского изделия» (рисунок 1).
Если изделие является медицинским, но заявитель не успел вовремя предоставить все запрашиваемые документы, то необходимо получить комплект регистрационного досье из РЗН, приложить к нему недостающие документы и указать их в описи, затем заверить Заявление о регистрации новым номером и датой и повторно подать комплект регистрационного досье на регистрацию.
Чтобы понять каким образом заявитель может получить обратно комплект регистрационного досье, он должен просмотреть информацию, указанную в п. 12 поданного Заявления о регистрации. Если в п. 12 указано: «на бумажном носителе лично представителю компании на основании доверенности», то заявитель должен получить комплект регистрационного досье через окно выдачи в Росздравнадзоре. Если в п. 12 указано: «по почте на юридический адрес заявителя», то необходимо дождаться документы по почте.

Рисунок 1 – Пример уведомления о возврате заявления о государственной регистрации медицинского изделия
I и II этапы рассмотрения документов
Как уже было сказано выше, изделия классов риска 2а, 2б, 3 после нулевого этапа переходят на I этап, где осуществляется экспертиза заявления о регистрации и документов, для определения возможности (невозможности) проведения клинических испытаний медицинского изделия. Если нарушения не выявлены или устранены, то выдается «Уведомление о принятии решения о выдаче разрешения на проведение испытаний медицинского изделия», что является переходом ко II этапу.
В то время как изделия 1 класса риска после нулевого этапа переходят сразу на II этап. Если нарушения не выявлены или устранены, то выдается регистрационное удостоверение.
Если на I этапе для изделий классов риска 2а, 2б и 3 и на II этапе для 1 класса риска направляется «Запрос о предоставлении дополнительных материалов и сведений», то заявитель должен устранить все замечания из уведомления в срок, не превышающий 50 рабочих дней.
Критерии для отказа в регистрации медицинского изделия на данных этапах:
1) заявитель предоставил не все документы, запрашиваемые экспертным учреждением;
2) заявитель не скорректировал информацию и не устранил недостатки в документации, к которой были замечания у экспертного учреждения;
3) заявитель не предоставил дополнения к протокам технических испытаний, заключению токсикологических исследований в зависимости от характера замечаний к ним и дополнений в технической документации, нуждающейся в проверке и подтверждении в аккредитованных лабораториях;
4) заявитель не приложил «Извещение об изменениях» к ТУ для изделий отечественного производства;
5) заявитель не предоставил скорректированные документы в срок 50 рабочих дней.
Уведомления и запросы Росздравнадзора содержат подробную информацию о характере и причине замечаний, тем не менее заявитель должен проанализировать и дополнить иные документы регистрационного досье скорректированной информацией, в которой она также должна быть указана или изменена.
Если замечание РЗН указывает на недостаточность технических характеристик, приведенных в технической документации, то все вновь добавленные характеристики должны быть проверены в аккредитованной лаборатории, а результаты проверки должны быть представлены в РЗН в виде дополнения к результатам ранее проведенных испытаний.
Необходимо соблюдать сроки устранения замечаний, регламентированных требованиями ППРФ №1416 от 27.12.2012 г. «Об утверждении правил государственной регистрации медицинских изделий».
В качестве оповещения об отказе на I этапе для изделий классов риска 2а, 2б и 3 и на II этапе для 1 класса риска направляется «Уведомление об отказе в государственной регистрации медицинского изделия» (рисунок 2, 3).
Если заявитель допустил хотя бы один критерий из возможных для отказа, то регистрационное досье заявителю не возвращается и направляется в архив Росздравнадзора.
Что бы не осуществлять повторную подачу всего регистрационного досье заново, достаточно выполнить следующие действия:- проработать все документы регистрационного досье, к которым были замечания и устранить их;
- подготовить, в случае необходимости, недостающие документы и дополнения к результатам испытаний;
- подготовить заявление о регистрации с новым номером и датой;
- подготовить сопроводительное письмо с указанием входящего номера и даты отказного досье в РЗН. Обязательно указать выдержки из уведомления об отказе и дать комментарии в каких документах и как именно замечание было устранено (рисунок 4);
- подготовить опись документов, в которой указать ссылку на документы, к которым ранее не было замечаний (рисунок 5).



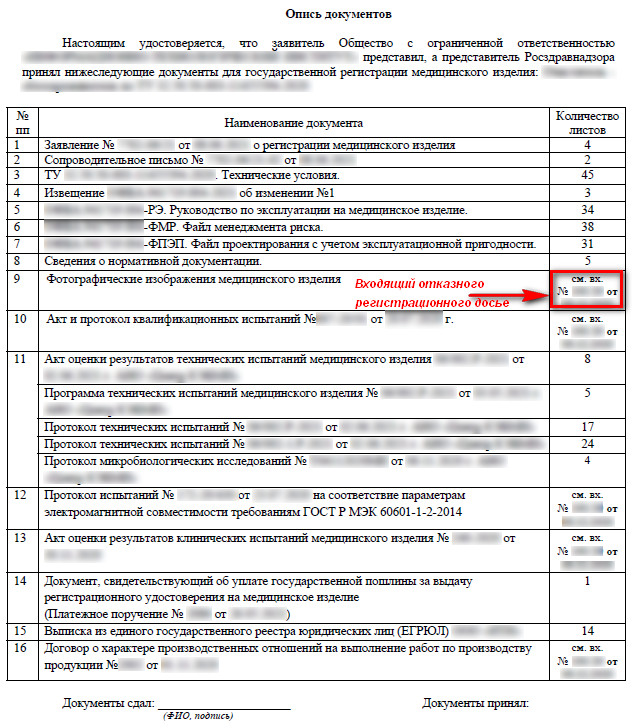
Рисунок 5 – Пример описи для повторной подачи дела со ссылкой на отказное регистрационного досье
II этап рассмотрения документов для медицинских изделий классов риска 2а, 2б и 3
После того, как медицинские изделия классов риска 2а, 2б и 3 прошли I этап экспертизы качества и эффективности и заявителем получено «Уведомление о принятии решения о выдаче разрешения на проведение клинических испытаний медицинского изделия» регистрация приостанавливается до тех пор, пока заявитель не направит Заключение клинических испытаний в ответ на данное уведомление. Возобновление регистрации обозначает, что регистрационное досье направлено на II этап рассмотрения документов.
При прохождении II этапа и положительном решении будет выдано регистрационное удостоверение. В случае, если результаты испытаний будут недостаточными или некорректными, то заявителю будет направлен «Запрос о предоставлении дополнительных материалов и сведений», который нужно устранить в срок, не превышающий 50 рабочих дней.
Критериями для отказа в регистрации медицинского изделия на II этапе:
1) заявитель не скорректировал информацию и не устранил недостатки в результатах клинических испытаний посредством выпуска дополнения;
2) заявитель не предоставил скорректированные документы в срок 50 рабочих дней.
Необходимо соблюдать сроки устранения замечаний, регламентированных требованиями ППРФ №1416 от 27.12.2012 г. «Об утверждении правил государственной регистрации медицинских изделий».
В качестве оповещения об отказе на II этапе рассмотрения документов для изделий классов риска 2а, 2б и 3 направляется «Уведомление об отказе в государственной регистрации».
Повторная подача регистрационного досье должна осуществлять по аналогии с предыдущим разделом (I и II этапы рассмотрения документов).
Заключение
В данной статье были рассмотрены случаи и ситуации, при которых заявитель может получить уведомление об отказе в государственной регистрации медицинского изделия, а также варианты повторной подачи регистрационного досье на регистрацию. Статья носит информационный характер, основанный на опыте регистрации медицинских изделий специалистами компании ООО «Невасерт».





