
Сведения о нормативной документации представляют собой документ, входящий в основной перечень документов регистрационного досье с целью осуществления государственной регистрации медицинского изделия.
Для начала рассмотрим определение нормативной документации, приведенное в ППРФ №1416 от 27 декабря 2012 г. «Об утверждении правил государственной регистрации медицинских изделий»:

«"Нормативная документация" - документы, регламентирующие требования безопасности, качества, а также предполагаемую эффективность предусмотренного применения и методы контроля соответствия медицинского изделия этим требованиям.»
Иными словами, документ содержащий сведения о нормативной документации представляет собой краткий свод всех нормативов, которым соответствует регистрируемое изделие. Строгой формы изложения и содержания сведений нет, документ не регламентирован. Потому, основываясь на многолетнем опыте работы, компания ООО «Невасерт» разработала определенную структуру построения документа «Сведения о нормативной документации» (далее – Документ).
1. Сведения о нормативной документации на изделие отечественного производства
Документ на изделия отечественного производства должен включать в себя следующую информацию:
- Наименование медицинского изделия;
- Сведения о разработчике, производителе, юридическом лице на имя которого может быть выдано регистрационное удостоверение, адрес места производства медицинского изделия;
- Нормативные документы, используемые при разработке и производстве изделия с указанием иного документа, которым данное соответствие подтверждается. Соответствие должно быть подтверждено Актом квалификационных испытаний.
- Свод нормативных документов (ГОСТы, технические условия и др.), которым регистрируемое изделие соответствует. Соответствие должно быть подтверждено Актом оценки результатов технических испытаний, Протоколом испытаний на соответствие параметрам электромагнитной совместимости (в случае применимости данного требования к изделию) и Заключением по результатам токсикологических исследований (кроме изделий лабораторного назначения).
- Перечень нормативных правовых актов и иных документов, применимых при подготовке комплекта регистрационного досье.
- Классификационные сведения: класс риска, код ОКПД2 и вид по номенклатурному классификатору.
- Дополнительные сведения в виде перечня технической, эксплуатационной и конструкторской документации.


на медицинское изделие отечественного производства
2. Сведения о нормативной документации на изделие иностранного производства
Документ на изделия иностранного производства должен включать в себя следующую информацию:
- Наименование медицинского изделия;
- Сведения о разработчике, производителе, юридическом лице на имя которого может быть выдано регистрационное удостоверение, уполномоченном представителе производителя, адреса мест производства медицинского изделия;
- Сводная таблица национальных и международных нормативных стандартов/документов в стране изготовителя, используемых при разработке и производстве медицинского изделия, по отношению к ним идентичных российских национальных стандартов/документов. После таблицы приводится перечень документов, подтверждающих соответствие изделия перечисленным стандартам.

Соответствие может подтверждаться следующими документами:
- Декларация соответствия в соответствии с Приложением VII Директивы по медицинским приборам 93/42/ЕЕС;
- Сертификатом системы менеджмента качества ISO 13485;
- Сертификатом системы менеджмента качества ISO 9001;
- Сертификатом Внутренней системы менеджмента качества (Самосертификация) и др.
- Свод нормативно-правовых документов, действующих на территории РФ, которым соответствует регистрируемое изделие (ГОСТы, выписка из технического файла и др.). Соответствие должно быть подтверждено документами, подтверждающими проведение испытаний изделия на территории РФ: Актом оценки результатов технических испытаний, Протоколом испытаний на соответствие параметрам электромагнитной совместимости (в случае применимости данного требования к изделию) и Заключением по результатам токсикологических исследований (кроме изделий лабораторного назначения).
- Перечень нормативных правовых актов и иных документов, применимых при подготовке комплекта регистрационного досье.
- Классификационные сведения: класс риска, код ОКПД2 и вид по номенклатурному классификатору.
- Дополнительные сведения в виде перечня технической и эксплуатационной документации.

ВНИМАНИЕ! Документ «Сведения о нормативной документации» на медицинское изделие иностранного производства заверяется уполномоченным представителем производителя.

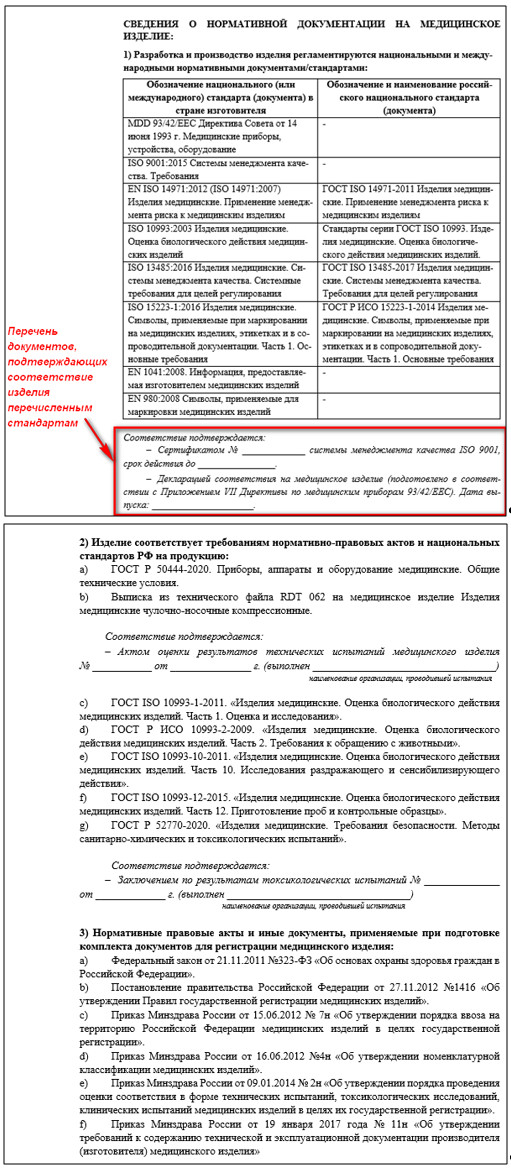
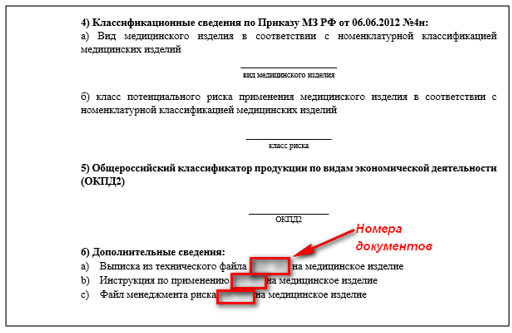
Рисунок 2 - Пример структуры и содержания документа
наизделие иностранного производства





