25 января 2018 года Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) было выдано регистрационное удостоверение № РЗН 2018/6768 на медицинское изделие: «Трубки трахеостомические, с принадлежностями» производства «Медерен Неотех Лтд. (Mederen Neotech Ltd.)», Израиль, уполномоченный представитель производителя медицинского изделия: Общество с ограниченной ответственностью "АЛЬФАМЕДЭКС"(ООО "АЛЬФАМЕДЭКС"), Россия, 197229, город Санкт-Петербург, проспект Лахтинский, дом 113, корпус ЛИТЕР А, офис 2.
Трубки применяются в медицинских учреждениях, врачом-специалистом для восстановления проходимости дыхательных путей, в особенности, вследствие обструкции трахеи, инфекции/заболевания ротовой полости или затруднения дыхания по другой причине. Трубки предназначены для длительного непрерывного применения в течение более 30 суток.
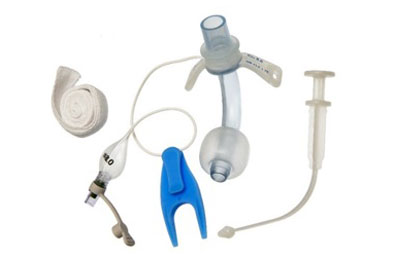
Трубка трахеостомическая - стерильное, одноразовое изделие. Выпускается в различных вариантах исполнения: с манжетой, без манжеты, с манжетой фенестированная, без манжеты фенестированная.
Трубка трахеостомическая с двумя внутренними канюлями – стерильное, одноразовое изделие. Выпускается в различных вариантах исполнения: с манжетой, без манжеты, с манжетой фенестированная, без манжеты фенестированная. Внутренние канюли необходимы для облегчения ухода за трубкой, при использовании канюль уменьшается риск окклюзии и исчезает необходимость в частой замене трубки. Канюли устанавливаются во внутренний просвет трахеостомических трубок, не препятствуют присоединению трубки к дыхательному контуру и к дополнительным устройствам (голосовому клапану, термовенту и др.).
Трубка трахеостомическая педиатрическая – стерильное, одноразовое изделие. Предназначена для применения в педиатрии. Выпускается без манжеты.
Трубки имеют следующие принадлежности:
- Разъединительный клин.
- Шейный ремешок, в вариантах исполнения:
- Стандартный.
- Стандартный педиатрический.
- Шейный ремешок для трубок трахеостомических.
- Обтюратор.
- Колпачок для наружной канюли.
Трубки, за исключением педиатрических, имеют 15-миллиметровый плавающий коннектор, качающийся под произвольным углом, что позволяет коннектору свободно двигаться, эффективно амортизирует давление и сводит к минимуму неудобства для пациента, когда он поворачивает голову или сгибает шею.
Фенестированные трубки имеют фонационные окна и предназначены для пациентов с сохраненными голосовыми связками. Воздух проходящий через дополнительные отверстия частично направляется в сторону голосовых связок, что облегчает голосообразование и хорошо подходит при использовании голосового клапана.
Для подтверждения соответствия медицинского изделия требованиям нормативных документов Сотрудниками ООО «Невасерт» были организованы все необходимые исследования и испытания для подтверждения качества и безопасности медицинского изделия, которые проводились в соответствующих аккредитованных лабораториях, имеющих полномочия на проведение работ по исследованиям и испытаниям.
Испытательной лабораторией была проведена оценка результатов технических испытаний в форме проведения испытаний и анализа данных на медицинское изделие: «Трубки трахеостомические, с принадлежностями», на соответствие требованиям:
ГОСТ Р 50444-92; ГОСТ 31054.1-2002; ГОСТ 31054.2-2002; ГОСТ ISO 7228-2011; ГОСТ ISO 11607-2011; Технической и Эксплуатационной документации.
Для проведения технических испытаний были представлены:
- Образцы медицинского изделия в вариантах исполнения.
- Заявка от ООО «АЛЬФАМЕДЭКС» о проведении технических испытаний медицинского изделия.
- Техническая документация.
- Эксплуатационная документация.
- Фотографические изображения общего вида медицинского изделия.
По результатам технических испытаний было сделано следующее заключение: Испытанное медицинское изделие:
Центром контроля качества были проведены токсикологические исследования медицинского изделия «Трубки трахеостомические, с принадлежностями» (в вариантах исполнения).
Для проведения токсикологических исследований были представлены:
- Заявление о проведении исследований.
- Сведения о нормативной документации на медицинское изделие.
- Техническая и эксплуатационная документация с перечнем национальных и межгосударственных стандартов, требованиям которых соответствует медицинское изделие.
- Образцы медицинского изделия в вариантах исполнения.
После оценки результатов исследований Изделия были сделаны выводы:
В Федеральном государственном учреждении, имеющем полномочия на проведение работ по испытаниям, была проведена оценка результатов клинических испытаний в форме оценки и анализа клинических данных в соответствии с нормативной документацией, с эксплуатационной и технической документацией на медицинское изделие, а также утвержденной программой клинических испытаний.
Для проведения клинических испытаний были представлены:
- Заявление на проведение клинических испытаний медицинского изделия.
- Сведения о нормативной документации на медицинское изделие.
- Фотографические изображения медицинского изделия.
- Эксплуатационная документация производителя.
- Техническая документация.
- Проект программы и методики клинических испытаний;
- Результаты технических испытаний: АКТ оценки результатов технических испытаний, Фотографические изображения общего вида медицинского изделия, Утвержденная программа технических испытаний медицинского изделия.
- Протокол технических испытаний.
- Результаты токсикологических исследований.
- Опытный образец медицинского изделия в вариантах исполнения.
- Сведения о взаимозаменяемом медицинском изделии.
- Разрешение Росздравнадзора на проведение клинических испытаний медицинского изделия.
- Документы (материалы), содержащие данные о клиническом применении медицинского изделия, в том числе за пределами Российской Федерации, в том числе обзоры, отчеты о проведенных научных исследованиях, публикации, доклады, анализ риска применения, методы применения медицинского изделия.
В процессе проведения клинических испытаний были исследованы:
- Назначение медицинского изделия, установленное производителем.
- Представленная техническая и эксплуатационная документация.
- Функциональные качества медицинского изделия, эффективность его применения, показания и противопоказания к его применению.
- Эксплуатационные качества медицинского изделия, возможности управления и удобство обращения с ним, техническая эстетика медицинского изделия, его оформление, устойчивость к дезинфекции, стерилизации.
- Информация об обнаруженных в процессе клинических испытаний недостатках конструкции и качества медицинского изделия (при наличии), особенности работы с ним в процессе эксплуатации.
- Сведения о взаимозаменяемых медицинских изделиях.
По результатам клинических испытаний были сделаны выводы:
Для регистрации медицинского изделия «Трубки трахеостомические, с принадлежностями» специалистами компании «Невасерт» был разработан и подан в Росздравнадзор пакет документов:
- Заявление о регистрации медицинского изделия.
- Разрешение на ввоз медицинского изделия с целью его государственной регистрации.
- Выписка из технической документации на медицинское изделие.
- Инструкция по применению медицинского изделия.
- Паспорта безопасности материалов на медицинское изделие.
- Сведения о нормативной документации на медицинское изделие.
- Фотографические изображения общего вида медицинского изделия.
- Доверенность от фирмы-производителя на регистрацию медицинского изделия в Российской Федерации.
- Платежное поручение об уплате государственной пошлины за регистрацию медицинского изделия.
- Платежное поручение об уплате государственной пошлины за проведение экспертизы качества, эффективности и безопасности медицинского изделия.
- Документы, подтверждающие регистрацию организации-изготовителя.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.
- Акт оценки результатов технических испытаний.
- Заключение по результатам токсикологических исследований.

Рис. 1: Благодарственное письмо от ООО "АЛЬФАМЕДЭКС.
Сканер-копии документов выложены с разрешения ООО "АЛЬФАМЕДЭКС.

Рис. 2: Регистрационное удостоверение на медицинское изделие «Трубки трахеостомические, с принадлежностями» производства «Медерен Неотех Лтд.», Израиль.
Рис. 3: Приложения к Регистрационному удостоверению на медицинское изделие «Трубки трахеостомические, с принадлежностями» производства «Медерен Неотех Лтд.», Израиль.
















