10 марта 2021 года Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) было выдано регистрационное удостоверение № РЗН 2021/13661 на медицинское изделие: «Наборы для имплантации подкожной порт-системы» производства «Медерен Неотех Лтд. (Mederen Neotech Ltd.)», Израиль, уполномоченный представитель производителя медицинского изделия: Общество с ограниченной ответственностью "АЛЬФАМЕДЭКС"(ООО "АЛЬФАМЕДЭКС"), Россия, 197229, город Санкт-Петербург, проспект Лахтинский, дом 113, корпус ЛИТЕР А, офис 2.
Изделие предназначено для обеспечения беспрепятственного долгосрочного доступа к сосудистому руслу с целью введения лекарственных препаратов или забора крови.
Изделие стерильное, для однократного применения у одного пациента, в течение непрерывного времени на протяжении нескольких месяцев до нескольких лет.
Принцип действия изделия: порт имплантируется под кожу и соединяется с установленным в вену катетером. При необходимости введения лекарственных препаратов в порт-систему используется игла Губера, с помощью которой раствор вводится в камеру порта, а затем попадает в катетер и соответственно в сосуд.
Порт-система – стерильное изделие, предназначенное для однократного применения одним пациентом.
Порт-системы можно классифицировать следующим образом:
В зависимости от типа доступа: венозные порт-системы; артериальные порт-системы; перитонеальные порт-системы.
В зависимости от материала порта: с пластиковым портом; с титановым портом.
В зависимости от типа модели порта: Standard; Low Profile; Micro; Power Injection; Standard; Power Injection; Low Profilе.
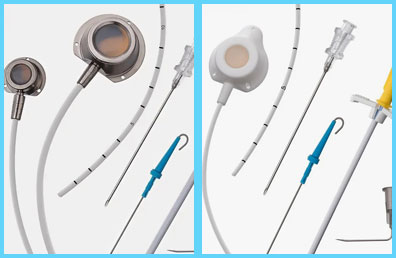
Набор для имплантации подкожной порт-системы состоит из следующих компонентов:
- Порт – представляет собой резервуар, имплантируемый подкожно, для введения лекарственных препаратов, препаратов крови и кровезаменителей, а также забора крови и проведения парентерального питания.
- Катетер силиконовый – представляет собой длинную, рентгеноконтрастную, гибкую трубку из силикона, предназначенную для инфузии лекарственных препаратов непосредственно в кровоток.
- Интродьюсер расщепляемый – предназначен для расширения входного отверстия для введения катетера.
- Игла пункционная – предназначена для проведения пункции центральных вен.
- Игла Губера – представляет собой полый трубчатый металлический инструмент с острым скошенным концом для осуществления подкожных инъекций/инфузий через порт.
- Проводник – предназначен для введения катетера с целью облегчения его установки.
- Туннелер – представляет собой металлическое изделие для туннелирования подкожной клетчатки в процессе установки катетера.
- Коннектор для промывания – предназначен для присоединения к катетеру и его промывания.
- Венолифтер – предназначен для удерживания сосуда во время установки катетера.
- Карточка пациента – предназначена для контроля за проведением инфузий в порт-систему и представляет собой буклет, сложенный в «гармошку», в которой записываются сведения об имплантации, таблица, в которую вносятся типы операций, сведения о промывании порта и дата и кем были осуществлены данные процедуры, а также вся необходимая информация о мерах предосторожности и противопоказаниях.
Изделие изготовлено из износостойкого, безопасного и биосовместимого материала, который обеспечивает взаимодействие изделия с тканями и жидкостями организма, другими материалами, имплантатами, веществами и газами. Изделие сохраняет свои эксплуатационные характеристики, свойства и качества, при влиянии на него: радиоактивного излучения, магнитных и электромагнитных полей.
Для подтверждения соответствия медицинского изделия требованиям нормативных документов Сотрудниками ООО «Невасерт» были организованы все необходимые исследования и испытания для подтверждения качества и безопасности медицинского изделия, которые проводились в соответствующих аккредитованных лабораториях, имеющих полномочия на проведение работ по исследованиям и испытаниям.
Испытательной лабораторией была проведена оценка результатов технических испытаний в форме проведения испытаний и анализа данных на медицинское изделие: «Наборы для имплантации подкожной порт-системы», на соответствие требованиям:
ГОСТ Р 50444-92; ГОСТ Р ИСО 14630-2017; ГОСТ ISO 11607-1-2018; ГОСТ Р ИСО 15223-1-2014; ГОСТ ISO 7864-2011; ГОСТ Р ИСО 6009-2013; ГОСТ 19126-2007; ГОСТ Р ИСО 11070-2010 ГОСТ ISO 10555-1-2011; ГОСТ ISO 10555-3-2011; технической и эксплуатационной документации.
Для проведения технических испытаний были представлены:
- Образцы медицинского изделия в вариантах исполнения.
- Заявка от ООО «АЛЬФАМЕДЭКС» на проведение технических испытаний.
- Выписка из технического файла.
- Паспорта безопасности материалов и сертификаты соответствия.
- Протокол валидации процесса стерилизации и упаковки.
- Заключение по результатам токсикологических исследований.
- Фотографические изображения медицинского изделия.
По результатам технических испытаний было сделано следующее заключение:
Центром контроля качества были проведены токсикологические исследования медицинского изделия «Наборы для имплантации подкожной порт-системы» (в вариантах исполнения).
Для проведения токсикологических исследований были представлены:
- Заявление о проведении исследований.
- Сведения о нормативной документации на медицинское изделие
- Техническая и эксплуатационная документация с перечнем национальных и межгосударственных стандартов, требованиям которых соответствует медицинское изделие.
- Образцы медицинского изделия в вариантах исполнения.
После оценки результатов исследований Изделия были сделаны выводы:
Медицинским исследовательским центром, имеющем полномочия на проведение работ по испытаниям, была проведена оценка результатов клинических испытаний в форме оценки и анализа клинических данных в соответствии с нормативной документацией, с эксплуатационной и технической документацией на медицинское изделие, а также утвержденной программой клинических испытаний.
Для проведения клинических испытаний были представлены:
Заявление на проведение клинических испытаний медицинского изделия.
- Сведения о нормативной документации на медицинское изделие
- Эксплуатационная документация производителя.
- Техническая документация.
- Проект программы и методики клинических испытаний.
- Фотографические изображения медицинского изделия.
- Результаты технических испытаний.
- Результаты токсикологических исследований.
- Опытный образец медицинского изделия в вариантах исполнения.
- Сведения о взаимозаменяемом медицинском изделии.
- Документы (материалы), содержащие данные о клиническом применении медицинского изделия, в том числе за пределами Российской Федерации, в том числе обзоры, отчеты о проведенных научных исследованиях, публикации, доклады, анализ риска применения, методы применения медицинского изделия.
В процессе проведения клинических испытаний были исследованы:
- Назначение медицинского изделия, установленное производителем.
- Представленная техническая и эксплуатационная документация.
- Функциональные качества медицинского изделия, эффективность его применения, показания и противопоказания к его применению.
- Эксплуатационные качества медицинского изделия, возможности управления и удобство обращения с ним, техническая эстетика медицинского изделия, его оформление, устойчивость к дезинфекции, стерилизации.
- Информация об обнаруженных в процессе клинических испытаний недостатках конструкции и качества медицинского изделия (при наличии), особенности работы с ним в процессе эксплуатации.
- Сведения о взаимозаменяемых медицинских изделиях.
По результатам клинических испытаний были сделаны выводы:
Для регистрации медицинского изделия «Наборы для имплантации подкожной порт-системы» специалистами компании «Невасерт» был разработан и подан в Росздравнадзор пакет документов:
- Заявление о регистрации медицинского изделия.
- Разрешение на ввоз медицинского изделия с целью его государственной регистрации
- Выписка из технической документации на медицинское изделие
- Инструкция по применению медицинского изделия
- Паспорта безопасности материалов на медицинское изделие
- Сведения о нормативной документации на медицинское изделие
- Фотографические изображения общего вида медицинского изделия
- Доверенность от фирмы-производителя на регистрацию медицинского изделия в Российской Федерации.
- Платежное поручение об уплате государственной пошлины за регистрацию медицинского изделия.
- Платежное поручение об уплате государственной пошлины за проведение экспертизы качества, эффективности и безопасности медицинского изделия.
- Документы, подтверждающие регистрацию организации-изготовителя.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.
- Акт оценки результатов технических испытаний.
- Заключение по результатам токсикологических исследований.

Рис. 1: Благодарственное письмо от ООО "АЛЬФАМЕДЭКС.
Сканер-копии документов выложены с разрешения ООО "АЛЬФАМЕДЭКС".

Рис. 2: Регистрационное удостоверение на медицинское изделие «Наборы для имплантации подкожной порт-системы» производства «Медерен Неотех Лтд.», Израиль
Рис. 3: Приложения к Регистрационному удостоверению на медицинское изделие «Наборы для имплантации подкожной порт-системы» производства «Медерен Неотех Лтд.», Израиль













