4 декабря 2020 года Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) было выдано регистрационное удостоверение № РЗН 2020/12770 на медицинское изделие: «Катетер внутривенный» производства «Медерен Неотех Лтд. (Mederen Neotech Ltd.)», Израиль, уполномоченный представитель производителя медицинского изделия: Общество с ограниченной ответственностью "АЛЬФАМЕДЭКС"(ООО "АЛЬФАМЕДЭКС"), Россия, 197229, город Санкт-Петербург, проспект Лахтинский, дом 113, корпус ЛИТЕР А, офис 2.
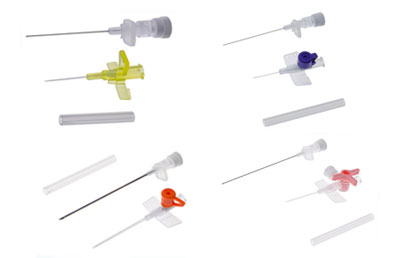
Медицинское изделие «Катетер внутривенный» предназначено для многократного введения жидкостей, лекарственных средств и/или забора проб крови через периферические вены человека. Срок использования катетера - не более 3 суток, это стерильное изделие, предназначенное для однократного применения у одного пациента.
Катетер – это изделие для доступа к системе кровообращения человека с целью введения жидкостей или лекарственных средств и/или забора проб крови. Катетеры снабжены рентгеноконтрастной линией по всей длине для проверки установки катетера, а также разъемом Луер-Лок расположенным на проксимальном конце катетера.
Катетеры предназначены для использования медицинским персоналом.
В зависимости от варианта исполнения катетер может быть оснащен:
- Крыльями/перфорированными крыльями – они позволяют надежно зафиксировать катетер на коже пациента, тем самым значительно снизить риск механического повреждения внутренней стенки сосуда и развития механического флебита, а также устраняют возможность несанкционированного извлечения.
- Инъекционным портом с разъемом луер-лок/с самозакрывающейся крышкой – предназначенным для болюсного введения лекарственных средств и промывания катетера, что обеспечивает возможность введения лекарств в процессе инфузии.
- Защитным колпачком (применимо к безопасным катетерам) – он предназначен для блокировки острия иглы пластиковой клипсой во время завершения тракционного движения при извлечении иглы из установленного в вену катетера, что позволяет предотвратить попытку повторного использования катетера, а также продвижения иглы в катетер при неудачной установке (устраняется возможность срезания катетера остриём иглы при попытке повторного продвижения).
- Павильоном мандрена - позволяет визуализировать обратный отток крови и контролировать размещение катетера в вене.
- Углублением для ранней индикации – выемка на конце иглы, позволяет визуализировать обратный отток крови в трубке катетере и контролировать размещение катетера в вене.
- Трёхходовым краном – позволяет осуществлять одновременное вливание двух различных лекарственных средств и/или жидкостей, а также позволяет взять образец пробы крови без повторной венепункции.
Каждый катетер имеет цветовую кодировку, которая позволяет определить размер катетера.
Для подтверждения соответствия медицинского изделия требованиям нормативных документов Сотрудниками ООО «Невасерт» были организованы все необходимые исследования и испытания для подтверждения качества и безопасности медицинского изделия, которые проводились в соответствующих аккредитованных лабораториях, имеющих полномочия на проведение работ по исследованиям и испытаниям.
Испытательным центром была проведена оценка результатов технических испытаний в форме проведения испытаний и анализа данных на медицинское изделие: «Катетер внутривенный», на соответствие требованиям: ГОСТ Р 50444-92, ГОСТ ISO 10555-1-2011, ГОСТ 19126-2007, ГОСТ ISO 10555-5-2012, ГОСТ ISO 11607-1-2018.
Для проведения технических испытаний были представлены:
- Заявка от о проведении технических испытаний медицинского изделия.
- Образцы медицинского изделия в вариантах исполнения.
- Техническая документация.
- Заключение токсикологических исследований.
- Инструкция по применению.
- Фотографические изображения общего вида медицинского изделия.
По результатам технических испытаний было сделано следующее заключение:
Лабораторным центром были проведены токсикологические исследования медицинского изделия «Катетер внутривенный» (в вариантах исполнения).
Для проведения токсикологических исследований были представлены:
- Заявление о проведении исследований.
- Сведения о нормативной документации на медицинское изделие
- Техническая и эксплуатационная документация с перечнем национальных и межгосударственных стандартов, требованиям которых соответствует медицинское изделие.
- Образцы медицинского изделия в вариантах исполнения.
После оценки результатов исследований Изделия были сделаны выводы:
Медицинским исследовательским центром, имеющем полномочия на проведение работ по испытаниям, была проведена оценка результатов клинических испытаний в форме оценки и анализа клинических данных в соответствии с нормативной документацией, с эксплуатационной и технической документацией на медицинское изделие, а также утвержденной программой клинических испытаний.
Для проведения клинических испытаний были представлены:
- Заявление на проведение клинических испытаний.
- Разрешение на проведение клинических испытаний.
- Сведения о нормативной документации, требованиям которых соответствует медицинское изделие.
- Техническая документация.
- Эксплуатационная документация на медицинское изделие.
- Фотографические изображения общего вида медицинского изделия.
- Акт оценки результатов технических испытаний медицинского изделия.
- Заключение по результатам токсикологических исследований.
- Образцы медицинского изделия в вариантах исполнения.
- Документы (материалы), содержащие данные о клиническом применении медицинского изделия, в том числе за пределами Российской Федерации, в том числе обзоры, отчеты о проведенных научных исследованиях, публикации, доклады, анализ риска применения, методы применения медицинского изделия:
- Данные клинической оценки Изготовителя.
- Сведения о взаимозаменяемом медицинском изделии.
- Отзыв о применении аналога.
В процессе проведения клинических испытаний были исследованы:
- Назначение медицинского изделия, установленное производителем.
- Представленная техническая и эксплуатационная документация.
- Функциональные качества медицинского изделия, эффективность его применения, показания и противопоказания к его применению.
- Эксплуатационные качества медицинского изделия, возможности управления и удобство обращения с ним, техническая эстетика медицинского изделия, его оформление, устойчивость к дезинфекции, стерилизации.
- Информация об обнаруженных в процессе клинических испытаний недостатках конструкции и качества медицинского изделия (при наличии), особенности работы с ним в процессе эксплуатации.
- Сведения о взаимозаменяемых медицинских изделиях.
По результатам клинических испытаний были сделаны выводы:
Для регистрации медицинского изделия «Катетер внутривенный» специалистами компании «Невасерт» был разработан и подан в Росздравнадзор пакет документов:
- Заявление о регистрации медицинского изделия.
- Разрешение на ввоз медицинского изделия с целью его государственной регистрации.
- Выписка из технической документации на медицинское изделие.
- Инструкция по применению медицинского изделия.
- Паспорта безопасности материалов на медицинское изделие.
- Сведения о нормативной документации на медицинское изделие.
- Фотографические изображения общего вида медицинского изделия.
- Доверенность от фирмы-производителя на регистрацию медицинского изделия в Российской Федерации.
- Платежное поручение об уплате государственной пошлины за регистрацию медицинского изделия.
- Платежное поручение об уплате государственной пошлины за проведение экспертизы качества, эффективности и безопасности медицинского изделия.
- Документы, подтверждающие регистрацию организации-изготовителя.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.
- Акт оценки результатов технических испытаний.
- Заключение по результатам токсикологических исследований.

Рис. 1: Благодарственное письмо от ООО "АЛЬФАМЕДЭКС"
Сканер-копии документов выложены с разрешения ООО "АЛЬФАМЕДЭКС".

Рис. 2: Регистрационное удостоверение на медицинское изделие: «Катетер внутривенный» производства «Медерен Неотех Лтд.», Израиль
Рис. 3: Приложения к Регистрационному удостоверению на медицинское изделие: «Катетер внутривенный» производства «Медерен Неотех Лтд.», Израиль




















