3 ноября 2022 года Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) было выдано регистрационное удостоверение № РЗН 2022/18714 на медицинское изделие: «Изделие для высокопоточной оксигенотерапии» производства «Фолькманн Медицин Техник ГмбХ», Германия, уполномоченный представитель производителя медицинского изделия: Общество с ограниченной ответственностью "АЛЬФАМЕДЭКС"(ООО "АЛЬФАМЕДЭКС"), Россия, 197229, город Санкт-Петербург, проспект Лахтинский, дом 113, корпус ЛИТЕР А, офис 2.
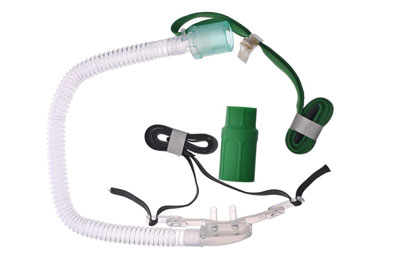
Медицинское изделие «Изделие для высокопоточной оксигенотерапии» (далее – Изделие) используются для кратковременной или постоянной подачи кислорода в дыхательные пути при назальной оксигенотерапии.
Принцип действия: назальный кончик канюли, соединённой с источником кислорода посредством трубки кислородной, вставляется в носовую полость пациента и обеспечивает подачу кислорода. Носовые канюли предотвращают повторный вдох выдыхаемого воздуха и удобны при длительном использовании.
Интубация высоким потоком используется для доставки большого количества кислорода пациентам, нуждающимся в кислородной терапии. Изделие подсоединяется через коннектор к трубке дыхательного контура и далее к кислородному баллону или устройству, называемому концентратором кислорода.
Изделие является неинвазивным устройством и предназначено для краткосрочного применения.
Существует множество вариантов исполнения данного медицинского изделия, приведем примеры некоторых:
- Изделие назальное для высокопоточной оксигенотерапии с гофрированной трубкой.
- Изделие трахеостомическое для высокопоточной оксигенотерапии с гофрированной трубкой.
- Изделие неонатальное для высокопоточной оксигенотерапии.
Для подтверждения соответствия медицинского изделия требованиям нормативных документов Сотрудниками ООО «Невасерт» были организованы все необходимые исследования и испытания для подтверждения качества и безопасности медицинского изделия, которые проводились в соответствующих аккредитованных лабораториях, имеющих полномочия на проведение работ по исследованиям и испытаниям.
Испытательной лабораторией была проведена оценка результатов технических испытаний в форме проведения испытаний и анализа данных на медицинское изделие: «Изделие для высокопоточной оксигенотерапии», на соответствие требованиям технического файла, ГОСТ Р ИСО 15223-1-2020.
Для проведения технических испытаний были представлены:
- Заявка на проведение испытаний.
- Акт отбора образцов.
- Акт приема-передачи образцов.
- Копия технического файла.
- Сведения о нормативной документации.
- Инструкция по применению медицинского изделия.
- Образцы медицинского изделия в вариантах исполнения.
По результатам технических испытаний было сделано следующее заключение:
Физико-химической лабораторией были проведены токсикологические исследования медицинского изделия «Изделие для высокопоточной оксигенотерапии» (в вариантах исполнения).
Для проведения токсикологических исследований были представлены:
- Заявление о проведении исследований.
- Сведения о нормативной документации на медицинское изделие.
- Техническая и эксплуатационная документация с перечнем национальных и межгосударственных стандартов, требованиям которых соответствует медицинское изделие.
- Образцы медицинского изделия в вариантах исполнения.
После оценки результатов исследований Изделия были сделаны выводы:
Медицинским исследовательским центром, имеющем полномочия на проведение работ по испытаниям, была проведена оценка результатов клинических испытаний в форме оценки и анализа клинических данных.
Для проведения клинических испытаний были представлены:
- Заявление на проведение клинических испытаний.
- Разрешение на проведение клинических испытаний.
- Проект программ и методики клинических испытаний.
- Техническая документация медицинского изделия.
- Эксплуатационная документация медицинского изделия.
- Сведения о нормативной документации, требованиям которых соответствует медицинское изделие.
- Фотографические изображения общего вида медицинского изделия
- Акт оценки результатов технических испытаний
- Заключение по результатам токсикологических исследований
- Документы (материалы), содержащие данные о клиническом применении медицинского изделия, в том числе за пределами Российской Федерации, в том числе обзоры, отчеты о проведенных научных исследованиях, публикации, доклады, анализ риска применения, методы применения медицинского изделия.
- Образцы медицинского изделия в вариантах исполнения.
В процессе проведения клинических испытаний были исследованы:
- Функциональные качества медицинского изделия, эффективность его применения, показания и противопоказания к его применению.
- Возможности медицинского изделия, касающиеся точности измерений, достоверности, воспроизводимости, надежности.
- Эксплуатационные качества медицинского изделия, возможности управления и удобство обращения с ним, техническая эстетика медицинского изделия, его оформление, устойчивость к дезинфекции, стерилизации.
- Информация об обнаруженных в процессе клинических испытаний недостатках конструкции и качества медицинского изделия (при наличии), особенности работы с ним в процессе эксплуатации.
- Сведения о взаимозаменяемых медицинских изделиях.
По результатам клинических испытаний были сделаны выводы:
Для регистрации медицинского изделия «Изделие для высокопоточной оксигенотерапии» специалистами компании «Невасерт» был разработан и подан в Росздравнадзор пакет документов:
- Заявление о регистрации медицинского изделия
- Разрешение на ввоз медицинского изделия с целью его государственной регистрации
- Выписка из технической документации на медицинское изделие
- Инструкция по применению медицинского изделия
- Паспорта безопасности материалов на медицинское изделие
- Сведения о нормативной документации на медицинское изделие
- Фотографические изображения общего вида медицинского изделия
- Доверенность от фирмы-производителя на регистрацию медицинского изделия в Российской Федерации.
- Платежное поручение об уплате государственной пошлины за регистрацию медицинского изделия.
- Платежное поручение об уплате государственной пошлины за проведение экспертизы качества, эффективности и безопасности медицинского изделия.
- Документы, подтверждающие регистрацию организации-изготовителя.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.
- Акт оценки результатов технических испытаний.
- Заключение по результатам токсикологических исследований.

Рис.1 Благодарственное письмо от ООО "АЛЬФАМЕДЭКС.
Сканер-копии документов выложены с разрешения ООО "АЛЬФАМЕДЭКС.

Рис. 2 Регистрационное удостоверение на медицинское изделие «Изделие для высокопоточной оксигенотерапии» производства «Фолькманн Медицин Техник ГмбХ», Германия

Рис. 3 Приложение к регистрационному удостоверению на медицинское изделие «Изделие для высокопоточной оксигенотерапии» производства «Фолькманн Медицин Техник ГмбХ», Германия





