2 июня 2022 года Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) было выдано регистрационное удостоверение № РЗН 2022/17442 на медицинское изделие: «Иглы - бабочки» производства «Медерен Неотех Лтд. (Mederen Neotech Ltd.)», Израиль, уполномоченный представитель производителя медицинского изделия: Общество с ограниченной ответственностью "АЛЬФАМЕДЭКС"(ООО "АЛЬФАМЕДЭКС"), Россия, 197229, город Санкт-Петербург, проспект Лахтинский, дом 113, корпус ЛИТЕР А, офис 2.
Изделие предназначено для введения медикаментов в периферические малые вены или для забора крови на анализ, в том числе у детей и новорожденных.
Изделие – стерильное, однократного применения, предназначенное для временного использования в течении непрерывного времени на протяжении не более трёх суток.
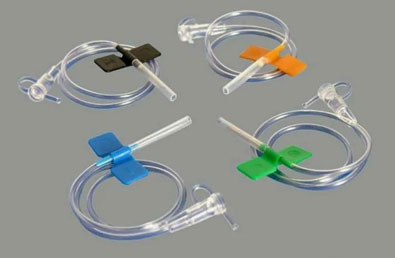
Игла-бабочка представляет собой тонкостенную стальную трубку иглы на проксимальном конце которой находится гибкая, тонкая, прозрачная трубка катетера. Трубка иглы имеет трёхгранную заточку для легкого введения в вену. Игла-бабочка имеет гибкие «крылышки» с цветовой кодировкой, в зависимости от размера иглы, цветовая кодировка позволяет легко и быстро выбрать нужное перфузионное устройство в соответствии с размером иглы. «Крылышки» обеспечивают легкую и эффективную фиксацию изделия на поверхности кожи. Игла-бабочка имеет защитный колпачок и заглушку на проксимальном конце трубки.
В зависимости от варианта исполнения, игла-бабочка может быть оснащена:
- системой защиты от укола – позволяет сократить риск укола трубкой иглы;
- Луер адаптером (в этом случае заглушка отсутствует, т.к. в ней нет необходимости) – предназначен для крепления к любой модели вакуумного контейнера для забора крови с держателем;
- держателем (в этом случае заглушка отсутствует, т.к. в ней нет необходимости) – предназначен для установки вакуумной пробирки.
Изделие предназначено для использования врачом-специалистом.
Для подтверждения соответствия медицинского изделия требованиям нормативных документов Сотрудниками ООО «Невасерт» были организованы все необходимые исследования и испытания для подтверждения качества и безопасности медицинского изделия, которые проводились в соответствующих аккредитованных лабораториях, имеющих полномочия на проведение работ по исследованиям и испытаниям.
Испытательной лабораторией технических средств по требованиям безопасности проведена оценка результатов технических испытаний в форме проведения испытаний и анализа данных на медицинское изделие: «Иглы-бабочки, в вариантах исполнения», на соответствие требованиям ГОСТ Р ИСО 15223-1-2014, ГОСТ ISO 7864-2011, ГОСТ 19126-2007, ГОСТ Р ИСО 9626-2020, ГОСТ ISO 11607-1-2018, ГОСТ ISO 11607-2-2018, ГОСТ EN 556-1-2011, Выписки из технической документации и Инструкции по применению.
Для проведения технических испытаний были представлены:
- Образцы медицинского изделия в вариантах исполнения.
- Заявка-обязательство на проведение технических испытаний.
- Выписка из технического файла.
- Инструкция по применению на медицинское изделие.
- Заключения по результатам токсикологических исследований.
- Отчёт о проверке продукта.
- Фотографии изделия.
По результатам технических испытаний было сделано следующее заключение:
Физико-химической и испытательной микробиологической лабораториями, а также лабораторией токсикологических исследований были проведены токсикологические исследования медицинского изделия «Иглы-бабочки».
Для проведения токсикологических исследований были представлены:
- Заявление о проведении исследований.
- Сведения о нормативной документации на медицинское изделие.
- Техническая и эксплуатационная документация с перечнем национальных и межгосударственных стандартов, требованиям которых соответствует медицинское изделие.
- Образцы медицинского изделия.
После оценки результатов исследований Изделия были сделаны выводы:
Для проведения клинических испытаний были представлены:
- Заявление на проведение клинических испытаний.
- Разрешение на проведение клинических испытаний.
- Проект программ и методики клинических испытаний.
- Техническая документация медицинского изделия.
- Эксплуатационная документация медицинского изделия.
- Сведения о нормативной документации, требованиям которых соответствует медицинское изделие.
- Фотографические изображения общего вида медицинского изделия.
- Акт оцени результатов технических испытаний медицинского изделия.
- Заключение по результатам токсикологических исследовании.
- Документы (материалы), содержащие данные о клиническом применении медицинского изделия, в том числе за пределами Российской Федерации, в том числе обзоры, отчеты о проведенных научных исследованиях, публикации, доклады, анализ риска применения, методы применения медицинского изделия:
- Данные клинической оценки Изготовителя.
- Сведения о взаимозаменяемом медицинском изделии (Таблица сравнения технических характеристик).
- Отзыв о применении взаимозаменяемого медицинского изделия (аналога).
- Образцы медицинского изделия в вариантах исполнения.
Вот некоторые из этапов проведения клинических испытаний:
- Анализ технической и эксплуатационной документации.
- Определение назначения медицинского изделия, среды, в которой применяется медицинское изделие, показания и противопоказания к применению.
- Определен потенциальный риск медицинского изделия.
- Анализ риска применения.
- Проведено оценивание конструкции и опробование работы опытных образцов (имитация работы).
- Ознакомление медицинского персонала с технической документацией, инструкцией по применению, правилами работы с изделием, техникой безопасности при его эксплуатации.
- Исследование функциональных качеств медицинского изделия, эффективность его применения, показания и противопоказания к его применению.
По результатам клинических испытаний были сделаны выводы:
Для регистрации медицинского изделия «Иглы-бабочки» специалистами компании «Невасерт» был разработан и подан в Росздравнадзор пакет документов:
- Заявление о государственной регистрации медицинского изделия с описью документов.
- Техническая документация производителя на медицинское изделие.
- Инструкция по применению медицинского изделия.
- Сведения о нормативной документации на медицинское изделие.
- Фотографические изображения общего вида медицинского изделия вместе с принадлежностями, необходимыми для применения медицинского изделия по назначению.
- Доверенность от фирмы-производителя на регистрацию медицинского изделия в Российской Федерации.
- Копия разрешения на ввоз.
- Платежное поручение об уплате государственной пошлины за регистрацию медицинского изделия.
- Платежное поручение об уплате государственной пошлины за проведение экспертизы качества, эффективности и безопасности медицинского изделия.
- Документы, подтверждающие регистрацию организации-изготовителя.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.

Рис.1 Благодарственное письмо от ООО "АЛЬФАМЕДЭКС.
Сканер-копии документов выложены с разрешения ООО "АЛЬФАМЕДЭКС.

Рис. 2 Регистрационное удостоверение на медицинское изделие «Иглы - бабочки» производства «Медерен Неотех Лтд. (Mederen Neotech Ltd.)», Израиль.
Рис. 3 Приложения к Регистрационному удостоверению на медицинское изделие «Иглы - бабочки»
производства «Медерен Неотех Лтд. (Mederen Neotech Ltd.)», Израиль.







