27 августа 2019 года Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) было выдано регистрационное удостоверение № РЗН 2018/7730 на медицинское изделие: «Игла для эпидуральной анестезии» производства «Медерен Неотех Лтд. (Mederen Neotech Ltd.)», Израиль, уполномоченный представитель производителя медицинского изделия: Общество с ограниченной ответственностью "АЛЬФАМЕДЭКС"(ООО "АЛЬФАМЕДЭКС"), Россия, 197229, город Санкт-Петербург, проспект Лахтинский, дом 113, корпус ЛИТЕР А, офис 2.
Медицинское изделие: «Игла для эпидуральной анестезии» (далее – Игла, Изделие) используется для инъекции анестетика в эпидуральную полость при применении местной анестезии.
Игла – это стерильное, одноразовое изделие для применения у одного пациента. Специальный изогнутый кончик острия обеспечивает точное и атравматичное позиционирование иглы в эпидуральном пространстве. Острие иглы не имеет заусенцев. На наружной поверхности иглы не должно быть обнаружено посторонних частиц, трещин, царапин, следов металлической пыли и обрабатывающих агентов.
Маркировка длины иглы с шагом 1 см позволяет точно определить глубину ее установки (прокола).
На трубку иглы надевается предохранительный колпачок, изготовленный из бесцветного материала, длиной 100 ±3 мм, диаметром 6±0.5 мм.
Существует множество вариантов исполнения данного медицинского изделия, например, Игла для эпидуральной анестезии, Tuohy имеет три варианта исполнения, в зависимости от типа павильона: стандартный тип павильона, тип павильона Rosy и Petals. На рисунке 1 показан пример внешнего вида иглы, в зависимости от типа павильона.
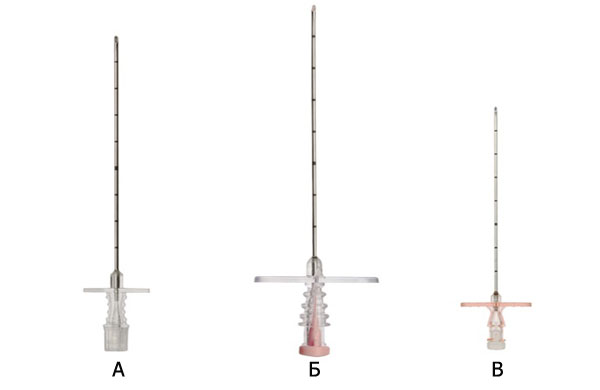
Рис. 1 Внешний вид иглы для эпидуральной анестезии Tuohy
- А - игла со стандартным типом павильона;
- Б - игла с типом павильона Petals;
- В - игла с типом павильона Rosy.
Для подтверждения соответствия медицинского изделия требованиям нормативных документов Сотрудниками ООО «Невасерт» были организованы все необходимые исследования и испытания для подтверждения качества и безопасности медицинского изделия, которые проводились в соответствующих аккредитованных лабораториях, имеющих полномочия на проведение работ по исследованиям и испытаниям.
Испытательной лабораторией была проведена оценка результатов технических испытаний в форме проведения испытаний и анализа данных на медицинское изделие на соответствие требованиям: ГОСТ Р 50444-92, ГОСТ ISO 7864-2011, ГОСТ ISO 11607-2011, выписки из технической документации и инструкции по применению.
Для проведения технических испытаний были представлены:
- Образцы медицинского изделия в вариантах исполнения.
- Заявка о проведении технических испытаний.
- Инструкция по применению;
- Выписка из технической документации;
- Заключение по результатам токсикологических исследований.
- Отчет физической валидации по стерилизации этилена оксида.
- Файл менеджмента риска.
- Фотографические изображения общего вида медицинского изделия.
По результатам технических испытаний было сделано следующее заключение:
Лабораторным центром были проведены токсикологические исследования медицинского изделия «Игла для эпидуральной анестезии».
Для проведения токсикологических исследований были представлены:
- Заявление о проведении исследований.
- Сведения о нормативной документации на медицинское изделие.
- Техническая и эксплуатационная документация с перечнем национальных стандартов, требованиям которых соответствуют медицинское изделие.
- Образцы медицинского изделия в вариантах исполнения.
После оценки результатов исследований были сделаны выводы:
В Федеральном государственном учреждении здравоохранения, имеющем полномочия на проведение работ по испытаниям, была проведена оценка результатов клинических испытаний медицинского изделия «Игла для эпидуральной анестезии» в соответствии с утвержденной программой клинических испытаний медицинского изделия.
Для проведения клинических испытаний были представлены:
- Заявление на проведение клинических испытаний;
- Разрешение на проведение испытаний медицинского изделия.
- Сведения о нормативной документации.
- Выписка из технической документации на медицинское изделие.
- Инструкция по применению.
- Фотографические изображения общего вида медицинского изделия.
- Акт оценки результатов технических испытаний.
- Заключение по результатам токсикологических исследований.
- Клинические данные изготовителя с переводом на русский язык в установленном порядке.
- Таблица сравнения со взаимозаменяемым медицинским изделием.
- Отзыв учреждения здравоохранения о применении взаимозаменяемого медицинского изделия.
- Образцы медицинского изделия в вариантах исполнения.
В процессе проведения клинических испытаний были исследованы:
- Функциональные качества медицинского изделия, эффективность его применения, показания и противопоказания к его применению.
- Возможности медицинского изделия, касающиеся точности измерений, достоверности, воспроизводимости, надежности.
- Эксплуатационные качества медицинского изделия, возможности управления и удобство обращения с ним, техническая эстетика медицинского изделия, его оформление, устойчивость к дезинфекции, стерилизации.
- Информация об обнаруженных в процессе клинических испытаний недостатках конструкции и качества медицинского изделия (при наличии), особенности работы с ним в процессе эксплуатации.
- Сведения о взаимозаменяемых медицинских изделиях.
По результатам клинических испытаний были сделаны выводы:
Для регистрации медицинского изделия «Игла для эпидуральной анестезии» специалистами компании «Невасерт» был разработан и подан в Росздравнадзор пакет документов:
- Заявление о государственной регистрации медицинского изделия с описью документов
- Техническая документация производителя на медицинское изделие
- Инструкция по применению медицинского изделия
- Сведения о нормативной документации на медицинское изделие
- Фотографические изображения общего вида медицинского изделия вместе с принадлежностями, необходимыми для применения медицинского изделия по назначению.
- Доверенность от фирмы-производителя на регистрацию медицинского изделия в Российской Федерации.
- Копия разрешения на ввоз.
- Платежное поручение об уплате государственной пошлины за регистрацию медицинского изделия.
- Платежное поручение об уплате государственной пошлины за проведение экспертизы качества, эффективности и безопасности медицинского изделия.
- Документы, подтверждающие регистрацию организации-изготовителя.
- Документы, подтверждающие соответствие условий производства медицинского изделия требованиям законодательства Российской Федерации.

Рис. 2 Благодарственное письмо от ООО "АЛЬФАМЕДЭКС.
Сканер-копии документов выложены с разрешения ООО "АЛЬФАМЕДЭКС.

Рис. 3 Регистрационное удостоверение на медицинское изделие «Игла для эпидуральной анестезии» производства «Медерен Неотех Лтд.», Израиль

Рис. 4 Приложение к Регистрационному удостоверению на медицинское изделие «Игла для эпидуральной анестезии» производства «Медерен Неотех Лтд.», Израиль





